微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某溶液中可能含有Cl-、I-、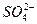 、
、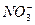 、
、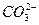 、
、 ,现进行如下实验:
,现进行如下实验:
(1)取部分溶液,加入过量Ba(NO3)2溶液,有白色沉淀生成,过滤出的沉淀部分溶于稀HNO3,并放出气体。
(2)取部分滤液,加入过量NaOH溶液,无沉淀产生。
(3)取部分滤液,加入AgNO3溶液,只有黄色沉淀生成。
根据上述现象,试判断:溶液中肯定存在的离子是____________,肯定不存在的离子是____________,可能存在的离子是____________。
参考答案: 本题解析:由(1)生成的沉淀部分溶于稀HNO3,可知一定含有
本题解析:由(1)生成的沉淀部分溶于稀HNO3,可知一定含有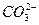 、
、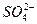 ;由(2)加入NaOH溶液,若有
;由(2)加入NaOH溶液,若有 本题难度:简单
本题难度:简单
2、选择题 下列有关物质性质的应用正确的是
A.石英坩埚耐高温,可用来加热熔化NaOH固体
B.浓硫酸有脱水性,可用作干燥剂
C.二氧化硫有漂白性,可大量用于加工食品使食品漂白
D.医用酒精能使蛋白质变性,可用来消毒杀菌
参考答案:D
本题解析:
试题分析:A、石英坩埚中的SiO2是酸性氧化物,与NaOH反应,所以不能用石英坩埚加热融化NaOH固体,错误;B、浓硫酸作干燥剂是利用了浓硫酸具有吸水性的性质,错误;C、二氧化硫有毒,不能用于加工食品使食品漂白,错误;D、医用酒精能使蛋白质变性,可用来消毒杀菌,正确。
本题难度:简单
3、选择题 将过量的金属锌投入到含0.200 mol H2SO4的热、浓硫酸中,下列判断正确的是(???)
A.因发生“钝化”而不反应
B.产生的SO2为0.100 mol
C.产生的SO2少于0.100 mol
D.除SO2外还会有H2产生
参考答案:CD
本题解析:A.Al、Fe遇冷的浓H2SO4“钝化”,Zn遇浓H2SO4不发生“钝化”。B.按理论值计算生成0.100 mol SO2,但实际反应中浓H2SO4浓度变稀时,不再生成SO2,而生成H2,故实际产生的SO2少于0.100 mol。
本题难度:简单
4、选择题 下列叙述正确的是
①标准状况下,1molSO2和1molSO3的体积相同;②SO2通入BaCl2溶液中不会有沉淀生成;③SO2有漂白性,而湿润的氯气也有漂白性,因此将SO2和Cl2以等物质的量混合后漂白作用更强;④SO2既有氧化性又有还原性;⑤SO2通入Ba(OH)2溶液中有白色沉淀生成,若加入足量的稀硝酸,沉淀将全部溶解
A.①②
B.②④⑤
C.②④
D.③⑤
参考答案:C
本题解析:略
本题难度:简单
5、选择题 常温下,向20L真空溶器中通入amol H2S和bmol SO2 (a、b都是正整数,且a≤5,b≤5)反应完毕后,容器内气体可能达到的最大密度是( )
A.24.5g/L
B.14.4g/L
C.8g/L
D.5.1g/L
参考答案:B
本题解析:
【错解分析】这是一道计算类型的选择题。题中出现数据含字母,且有取值范围,若讨论最大密度,需考虑极值。
【正解】该题涉及的反应方程式为:2H2S+SO2=3S+2H2O,反应完毕后,在常温下,只能余H2S或SO2为气体。若余H2S,当a=5,b=1时,H2S余的最多,为1.5mol(51g);若余SO2,当a="1," b=5时,SO2余的最多,为4.5mol(288g)。体积相同的情况大,显然余SO2,余的越多,反应完毕后的气体密度越大。极限值为SO2 4.5mol。则 本题难度:简单
本题难度:简单