微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一??焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
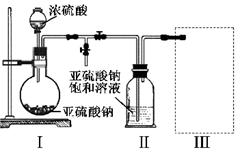
(1)装置I中产生气体的化学方程式为?????????????????。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是???????????????????。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为??????????????(填序号)。

实验二????焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-?????的电离程度大于水解程度,可采用的实验方法是???????(填序号)。
a.测定溶液的pH???? b.加入Ba(OH)2溶液?? c.加入盐酸??
d.加入品红溶液? e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是?????????????????????????。
实验三?葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为???????????????g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果?????(填“偏高”“偏低”或“不变”)。
参考答案:
⑴Na2SO3+H2SO4=Na2SO4+SO2↑+
本题解析:
试题分析:⑴装置I中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水,根据观察法将其配平。
⑵装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体。
⑶处理过量的SO2尾气,A项装置瓶口封闭,错误;B项食盐水不能将大量的SO2尾气吸收,错误;C项漏斗口没入了液体中,错误,D项氢氧化钠溶液可吸收SO2尾气,同时能防倒吸,正确。
⑷若NaHSO3溶液中HSO3-?????的电离程度大于水解程度,则所得溶液显弱酸性,可通过测定溶液的pH(pH<7),用蓝色石蕊试纸检测(显红色
本题难度:一般
2、选择题 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如下图所示。下列有关三硫化四磷说法中正确的是
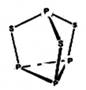
A.该物质中磷元素的化合价为+3
B.该物质分子中含有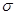 键和
键和 键
键
C.该物质的熔、沸点比食盐高
D.该物质22g含硫原子的数目约为1.806×1023
参考答案:D
本题解析:
试题分析:A.在P4S3分子中,最上边的P化合价为+3价,下边是3个P的化合价为+1价。错误。B.在物质分子中只有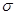 键。错误。C.该物质是物质晶体,熔沸点比离子化合物食盐低。错误。D.22g该物质的物质的量为22g÷220g/mol=0.1mol,每1mol的该化合物中含有S原子3mol,所以含硫原子的数
键。错误。C.该物质是物质晶体,熔沸点比离子化合物食盐低。错误。D.22g该物质的物质的量为22g÷220g/mol=0.1mol,每1mol的该化合物中含有S原子3mol,所以含硫原子的数
本题难度:简单
3、选择题 硫酸是用途广泛的化工原料,可作脱水荆、吸水荆、氧化剂和催化荆等。
工业制硫酸铜的方法很多。
(1)方法一、用浓硫酸制取硫酸铜。该反应的化学方程式是____????????????????,
此法的最大缺点是__????????????????__。
(2) 方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
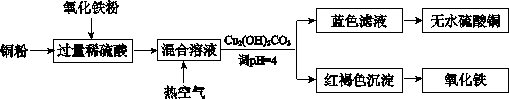
稀硫酸、铜和来源:91考试网氧化铁反应的离子方程式是??????????????????、?????????????????;向混合溶液中通人热空气的反应的离子方程式是??????????????????;由滤液得到无水硫酸铜的实验操作是?????????????????????????。
参考答案:(1)Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2
本题解析:
试题分析:
铜和浓硫酸反应,缺点是产生二氧化硫污染空气。
略
本题难度:一般
4、填空题 在下列反应中:?
2FeO+4H2SO4(浓)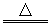 Fe2(SO4)3+SO2↑+4H2O?
Fe2(SO4)3+SO2↑+4H2O?
H2SO4表现出的性质是____________,FeO表现出的性质是____________;该反应的氧化产物和还原产物的物质的量之比是____________。
参考答案:氧化性和酸性 还原性和碱性 1∶1
本题解析:H2SO4变为盐〔Fe2(SO4)3〕和水,表现了H2S+6O4的酸性;H2SO4变为S+4O2,表现了H2SO4的氧化性。FeO变为盐〔Fe2(SO4)3〕和水,表现了FeO的碱性;F+2eO变为F+3e2(SO4)3,表现FeO的还原性。氧化产物是Fe2(SO4)3,还原产物是SO2,二者物质的量之比为其化学计量数之比即1∶1。
本题难度:简单
5、计算题 (7分)某化工厂生产硫酸,某硫矿中硫单质的质量分数为88%。若取该矿石1.00 t,最多可制得98%的浓硫酸多少t?(假设生产过程中有2%的矿石损失)
参考答案:2.7 t
本题解析:根据S原子守恒得
S ~ H2SO4
32??????????????????? 98
1.00 t×88%×(1-2%)??m(浓H2SO4)×98%
?m(浓H2SO4)=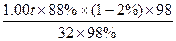 ?="2.7" t。
?="2.7" t。
本题难度:一般