微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中有关物质的量浓度关系正确的是
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-) >c(H+)> c(OH-)
B.pH 相等的CH3COONa 和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)= c(A-)
D.0.1 mol·L-1的NaHA 溶液 pH=l:c(Na+)= c(H2A) + c(HA-) + c(A2-)
参考答案:C
本题解析:试题解析:NaHSO3溶液显酸性,则HSO3-的电离程度大于水解程度,根据HSO3- H++SO32-和H2O
H++SO32-和H2O![]() H++OH-,可知溶液中c(H+)>c(SO32-),A错;H2CO3的酸性弱于CH3COOH,因此CO32-的水解程度大于CH3COO-,故pH相等的CH3COONa 和Na2CO3溶液,c(CH3COONa)>c(Na2CO3),B错;HA与MOH溶液混合后显中性,则c(H+)=c(OH-),根据电荷守恒有c(H+)+c(M+)=c(OH-)+c(A-),故c(M+)= c(A-),C正确;0.1 mol·L-1的NaHA 溶液 pH=l,说明HA-离子完全电离,H2A是强酸,HA-不水解,D错。
H++OH-,可知溶液中c(H+)>c(SO32-),A错;H2CO3的酸性弱于CH3COOH,因此CO32-的水解程度大于CH3COO-,故pH相等的CH3COONa 和Na2CO3溶液,c(CH3COONa)>c(Na2CO3),B错;HA与MOH溶液混合后显中性,则c(H+)=c(OH-),根据电荷守恒有c(H+)+c(M+)=c(OH-)+c(A-),故c(M+)= c(A-),C正确;0.1 mol·L-1的NaHA 溶液 pH=l,说明HA-离子完全电离,H2A是强酸,HA-不水解,D错。
考点:考查盐类的水解。
本题难度:一般
2、选择题 阿斯匹林(分子式为C9H8O4)是人们熟知的治感冒药,具有解热镇痛作用。它的摩尔质量是
A.148g
B.148g/mol
C.180g/mol
D.146g
参考答案:C
本题解析:根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得阿司匹林的相对分子质量为:12×9+8+16×4=180;摩尔质量是180g/mol 。
本题难度:困难
3、选择题 下列应用不涉及氧化还原反应的是
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
参考答案:D
本题解析:
试题分析:判断是否涉及到氧化还原反应,即判断反应过程中各元素化合价有无发生变化。通过判断,可知,选项D中发生的反应,各元素的化合价均无发生变化。因此答案选D。
考点:考查氧化还原反应。
本题难度:一般
4、填空题 写出下列反应的方程式:(第一个方程式需用双线桥法标出电子转移的方向和数目)
(1)工业制漂白粉的原理 ;
(2)过氧化钠与二氧化碳 。
参考答案:
(5分)(1)2Cl2+2Ca(OH)2=CaCl2
本题解析:
试题分析:(1)工业上用氯气与氢氧化钙溶液反应制取漂白粉,化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;氯气既是氧化剂又是还原剂,用双线桥表示为
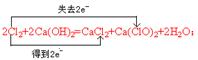
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,化学方程式为2Na2O2+2CO2=2Na2CO3+O2
考点:考查化学方程式的书写,双线桥的表示电子转移的方法
本题难度:一般
5、选择题 下列关于氧化还原反应的叙述,正确的是
A.失去电子的反应是还原反应
B.失去电子的物质是还原剂
C.发生氧化反应的物质是氧化剂
D.电子是从还原剂出发向氧化剂转移
参考答案:BD
本题解析:略
本题难度:一般