微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气。得到的二氧化氮与氧气通入水中,恰好被水完全吸收,试分析该硝酸盐分解时金属化合价的变化情况是(??? )???????????????????????????????????????????????
A.升高
B.降低
C.不变
D.不能确定
参考答案:C
本题解析:
试题分析:根据题意可知,NO2是还原产物,氧气是氧化产物。得到的二氧化氮与氧气通入水中,恰好被水完全吸收,这说明二者恰好反应又生成硝酸,所以根据电子的得失守恒可知,原硝酸盐中金属的化合价是不变的,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生灵活运用氧化还原反应的知识解决实际问题的能力,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生分析问题、解决问题的能力。
本题难度:简单
2、简答题 随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4
溶解性
可溶
难溶
难溶
易溶

请回答下列问题:
(1)23V在元素周期表位于第______周期______族.工业上由V2O5冶炼金属钒常用铝热剂法,其用化学方程式表示为______.
(2)反应①的目的是______.
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式______.
(4)用酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,写出配平后完整的离子方程式.
______VO2++______H2C2O4+______H+→______VO2++______?CO2+______.
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变
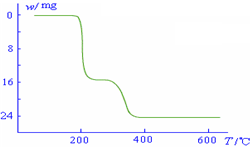
化的曲线如右图所示.则NH4VO3在分解过程中______.
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.
参考答案:(1)钒核外电子排布式为1s22s22p63s23p63d3
本题解析:
本题难度:一般
3、选择题 制备粗硅的反应为:SiO2+2C Si+2CO↑,其中氧化剂与还原剂的物质的量之比为 Si+2CO↑,其中氧化剂与还原剂的物质的量之比为
A.1 : 3
B.3 : 1
C.1 : 2
D.2 : 1
参考答案:C
本题解析:SiO2化合价降低,是氧化剂,C 化合价升高,是还原剂,SiO2与C 的物质的量之比为1 : 2,故选C。
本题难度:一般
4、选择题 Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是(? )
A.Na2O2在上述反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.Na2FeO4处理水时,既能杀菌,又能产生胶体净水
D.2 mol FeSO4发生反应时,共有10 mol电子发生转移
参考答案:A
本题解析:6份的Na2O2中只有1份中的氧失去电子变成氧气,另外5份中的氧得到电子变成-2价的氧,A项错;2 mol Fe2+转化为+6价的铁时,转移8 mol电子,再加上生成1 mol O2时Na2O2失去的2 mol电子,反应中共转移10 mol电子,D项对。
本题难度:一般
5、填空题 (1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得: SiO2 + C + N2 = Si3N4 + CO)
①配平上述反应的化学方程式
②该反应的平衡常数表达式为K=
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是 __ (填两种物质名称),其净水作用的原理是
参考答案:(1)③①② (2)否 否 (
本题解析:
试题分析:(1)应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、Fe3+等,过滤后加入盐酸可除去Na2CO3,故答案为:③①②;(2)催化剂不能使平衡移动,不能提高SO2的转化率,当然也不能增大该反应所放出的热量。(3)①Si的化合价前后未变,N的化合价由0降为-3,C的化合价由0升为+2,生成1个Si3N4化合价降低12,生成1个CO化合价升高2,根据化合价升降总数相等以及质量守恒得,3SiO2+6C+2N2 = Si3N4+6CO.故答案为:3、6、2、1、6;②固体或纯液体的浓度不改变,故该反应的平衡常数表达式为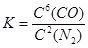 或 或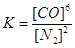
(4)明矾、硫酸铝、硫酸铁、硫酸亚铁中的阳离子铝离子,铁离子都能水解产生胶体能吸附水中的悬浮物,
铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的
考点:本题前半部分饱和食盐水的精制,催化剂原理,化学平衡常数表达式的书写和常见的净水剂等相关知识。
本题难度:困难
|