微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
A.c(CO32-)>c(H2CO3)
B.c(Na+)>c(HCO3-)>c(H+)>c(OH-)
C.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
参考答案:D
本题解析:
试题分析:HCO3-水解生成H2CO3和OH-,HCO3-电离生成CO32-和H+,由于pH=10,说明水解程度大于电离,A选项不正确,pH=10的NaHCO3溶液显碱性,c(OH-) >c(H+),B选项不正确,根据电荷守恒式,应为c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),C选项不正确,由物料守恒式,n(Na):n(C)=1:1,。D选项正确,。
本题难度:一般
2、填空题 pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
(1)写出正盐的化学式:______________________________。
(2)若该盐中只有一种离子水解,该离子水解的离子方程式为_________________________。
(3)简述该混合液呈碱性的原因。
参考答案:(1)BnAm
(2)Bm++mH2O![]()
本题解析:因为酸的pH与碱的pH之和等于14,等体积混合后pH=8>7,说明碱为弱碱,Bm+水解的离子方程式是:Bm++mH2O B(OH)m+mH+。HnA与B(OH)m等体积混合后,已电离的H+与OH-完全中和,弱碱继续电离产生OH-,显碱性。
B(OH)m+mH+。HnA与B(OH)m等体积混合后,已电离的H+与OH-完全中和,弱碱继续电离产生OH-,显碱性。
本题难度:简单
3、选择题 下列水解的离子方程式正确的是
A.HS-+H2O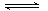 S2-+H3O+
S2-+H3O+
B.Fe3++3H2O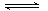 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C.CO32-+2H2O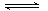 H2CO3+2OH-
H2CO3+2OH-
D.NH4++H2O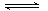 NH3·H2O+H+
NH3·H2O+H+
参考答案:D
本题解析:A:这是电离方程式,错误
B:水解是微弱过程,生成的碱不能标沉淀符号,不正确
C:多元弱酸根离子水解是分步进行的,并且以第一步水解为主,不正确
D:正确
本题难度:一般
4、填空题 (1)0.02 mol·L-1的HCN溶液与0.02 mol·L-1 NaCN溶液等体积混合,已知该混合溶液中c (Na+)> c(CN-),用“>、<、=”符号填空
①溶液中c(OH -)???????????c(H +)??????② c(HCN)????????c(CN-)
(2)常温下,向明矾溶液中滴入Ba(OH)2溶液至SO42- 刚好完全沉淀时,溶液
pH??7,(用“>、<、=”符号填空)反应的离子方程式为__________________________________。
(3)BaCO3分别加入:① 30mL水?②10mL 0.2mol/LNa2CO3溶液??③50mL 0.01mol/L
氯化钡溶液?④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中
Ba2+的浓度由大到小的顺序为:___________________________________________。
参考答案:(1)①?? > (2分),??② > (2分)
本题解析:(1)根据电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(CN-),所以当c (Na+)> c(CN-)时,c(OH -)>c(H +),这说明溶液显碱性,所以HCN的电离程度小于NaCN的水解程度,因此c(HCN)>c(CN-)。
(2)明矾是KAl(SO4)2,当SO42- 刚好完全沉淀时,需要2molBa(OH)2溶液,则此时铝离子恰好生成KAlO2,KAlO2水解显碱性,反应式为Al3++2SO42-+2Ba2++4OH- = 2BaSO4↓+ AlO2-。
本题难度:一般
5、选择题 标准状况下,将2.24LNH3通入1L 0.1mol/L的甲酸溶液中,欲确定所得溶液中NH4+、HCOO-、H+和OH-浓度大小顺序,通过下列数据即 可得出正确结论的是
①NH3·H2O和HCOOH的电离常数②NH3·H2O和HCOONH4的电离常数③溶液的pH
A.不需任何数据
B.必需知道①、②、③三组数据
C.只需知道①、③中的任一组数据
D.只需知道①、②、③中的任一组数据
参考答案:C
本题解析:
试题分析:解:A.酸和碱恰好反应生成盐,根据一水合氨和醋酸的电离常数确定其离子的水解程度,水解程度越大的离子,其浓度越小,不需要任何数据故A错误;B.醋酸铵是强电解质,在水中完全电离,所以醋酸铵是完全电离故B错误;C.根据溶液的pH知离子的水解程度,从而确定离子浓度大小,故C正确;D.题给反应物的用量不能说明离子的水解程度,故D错误;故选C.
本题难度:一般