微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分) 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
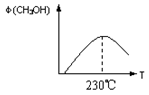
(1)合成甲醇的反应为:CO(g)+2H2(g)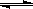 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(3)利用甲醇燃料电池设计如图所示的装置:
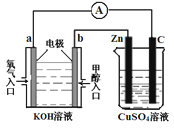
①则该装置中b为 极,写出装置中电解池内发生反应的离子方程式 ,
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为 L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)="=" C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)="=" C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式 。
参考答案:(10分)(1)<(1分)(2)0.55(2分)
(3
本题解析:略
本题难度:一般
2、填空题 (5分)在HF、H2O、NH3、CH4、CO32-、CO2、HI分子中
(1)CO32-的价层电子对的空间构型为??????
(2)以极性键相结合,具有正四面体结构的非极性分子是?????????????????。
(3)以极性键相结合,具有三角锥型结构的极性分子是???????????????????。
(4)以极性键相结合,具有V型结构的极性分子是?????????????????????。
(5)以极性键相结合,而且分子极性最大的是???????????????????????????。
参考答案:(1)平面三角型??(2)CH4???(3)NH3???(4
本题解析:
试题分析:(1)CO32-的价层电子对的空间构型为平面三角型;(2)以极性键相结合,具有正四面体结构的非极性分子是CH4分子;(3)以极性键相结合,具有三角锥型结构的极性分子是NH3分子;(4)以极性键相结合,具有V型结构的极性分子是H2O分子;(5)以极性键相结合,而且分子极性最大的是HF分子,
本题难度:一般
3、填空题 (5分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1))氢气在燃烧时,放出大量热量,说明该反应是 热反应,这是由于反应物的总能量 生成物的总能量(填“大于”、“小于”或“等于”,下同);从化学反应的本质角度来看,由于断裂反应物中的化学键吸收的总能量 形成产物的化学键放出的总能量
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2g氢气燃烧时放出286kJ热量,而每千克汽油燃烧时放出的热量为46000kJ。试据此分析氢气作为能源代替汽油的优势
。
参考答案:(1)放??大于???小于(各1分)
(2)清洁能源,
本题解析:考查化学反应中的能量变化。
(1)如果反应物的总能量高于生成物的总能量,反应就是放热反应,反之是吸热反应。如果从化学变化的本质分析,在化学反应中断键是吸热的,形成化学键是放热,如果断键吸收的能量高于形成化学键所放出的能量,反应就是吸热反应,反之是放热反应。
(2)氢气的燃烧产物是水,没有污染。其次根据所给的数据分析,单位质量的氢气的放出的热量多于汽油放出的热量。
本题难度:一般
4、选择题 已知反应?①2BrO3-+Cl2═Br2+2ClO3-;②5Cl2+I2+6H2O═2HIO3+10HCl;③ClO3-+5Cl-+6H+═3Cl2+3H2O,下列物质氧化能力强弱顺序正确的是
A.BrO3->ClO3->Cl2>IO3-
B.BrO3->Cl2>C1O3->IO3-
C.ClO3->BrO3->IO3->Cl2
D.Cl2>BrO3->ClO?3->IO3-
参考答案:A
本题解析:分析:在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
解答:①中BrO3-是氧化剂,ClO3-是氧化产物,所以氧化性BrO3->ClO3-,
②中Cl2是氧化剂,HIO3是氧化产物,所以氧化性Cl2>IO3-,
③中ClO3-是氧化剂,是Cl2氧化产物,所以氧化性ClO3->Cl2,
综上得氧化性顺序为BrO3->ClO3->Cl2>IO3-.
故选A.
点评:本题考查了根据方程式来比较氧化性和还原性.解题的关键是根据化合价找出氧化剂、还原剂、氧化产物和还原产物.
本题难度:简单
5、选择题 下列各组热化学方程式的ΔH前者大于后者的是
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+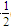 O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+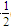 O2(g)===H2O(l) ΔH5
O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)==="Ca" (OH)2(s) ΔH8
A.①
B.④
C.②③④
D.①②③
参考答案:C
本题解析:
试题分析:①碳的燃烧反应是放热反应,ΔH<0;等质量的碳完全燃烧生成二氧化碳时放出的热量比不完全燃烧生成一氧化碳时放出的热量多,放热越多,ΔH越小,ΔH1<ΔH2。②等质量的气态硫单质完全燃烧生成二氧化硫时放出的热量比固态硫单质完全燃烧生成二氧化硫时放出的热量多,放出的热量越多,ΔH越小,ΔH4<ΔH3。③都生成液态水的前提下,氢气的质量越大,放出的热量越多,ΔH越小,ΔH6<ΔH5。④碳酸钙受热分解是吸热反应,ΔH>0;氧化钙溶于水是放热反应,ΔH<0, ΔH8<ΔH7。
考点:化学反应热效应
点评:此类题只要知道化学反应热效应的类型和判断其大小的方法,较为简单
本题难度:一般