微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式: 。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。
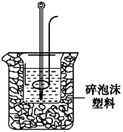
①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
②该装置中有一处错误是: 91Exam.org; ,如果用该错误装置测定,结果会 (填“偏
高”“偏低”“无影响”)
③如果,该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理
由是: 。在该实验中需要测定某种数据,
完成一次实验,需要测定该数据的次数为 次。
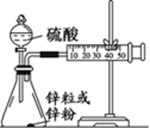
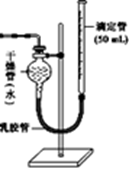
(3)学生乙用2 mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图(Ⅰ)装置:
图Ⅰ 图Ⅱ
①该生两次实验测定时间均设定为10 min,那么他还要测定的另一个数据是:
。
②如果将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所处的刻度数,发现滴定管中液面高于干燥管中液面,应先采取的操作是: 。③该实验结果中,你估计与酸反应较快的是 。
参考答案:(1) 1/2H2SO4(aq)+NaOH(aq)=1/2N
本题解析:
试题解析:(1)中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以该反应的热化学方程式是1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O ΔH=-57.3 kJ/mol。(2)①由于需要测量溶液的温度以及反应还需要搅拌,所以还缺少的玻璃仪器有温度计、环形玻璃搅拌棒。②根据装置图可知实验中没有用硬纸板(或塑料板)盖住烧杯,这样就会导致热量的损失,实验测定结果会偏低。③氢氧化钠过量可以保证硫酸完全反应,从而减少实验误差。实验中需要测量的数据是溶液的温度,因此至少需要测量3次,即反应前酸和碱的溶液温度,以及反应后溶液的温度。(3)①要比较反应速率的大小,除了测量时间外,还需要测定相同条件下生成氢气的体积。②由于气体的体积受温度和压强的影响,所以必须保证气体的压强和大气压是相同的,因此正确的操作是向下移动滴定管,直到两边液面相平。③由于锌粉的表面积大,反应速率快,即反应速率较快的是锌粉。
考点:热化学方程式的书写、中和热的测定以及影响反应速率的因素
本题难度:困难
2、选择题 下列图像表达正确的是( )
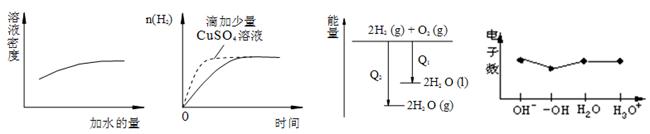
A.浓硫酸的稀释等量的锌粉反应
B.过量的盐酸与能量变化
C.氢气与氧气反应中的
D.微粒电子数
参考答案:D
本题解析:
试题分析:A、硫酸溶液的密度随浓度的增大而增大,图像不符合,A错误;B、锌与硫酸铜溶液发生置换反应是铜和硫酸锌,然后锌铜构成原电池加快反应速率,但由于消耗了锌得到的氢气减少,图像错误,B错误;C、氢气燃烧生成液态水放出的热量多余生成气态水放出的热量,图像错误,C错误;D、四种微粒的电子数分别是10、9、10、10,图像正确,D正确,答案选D。
考点:考查化学图像的分析判断
本题难度:一般
3、选择题 下列化合物中所有化学键都是共价键的是( )
A.Na2O2
B.NaOH
C.H2S04
D.BaCl2
参考答案:A、过氧化钠中钠离子和过氧根离子间存在离子键,氧原子和氧原子
本题解析:
本题难度:简单
4、选择题 向20mL?Na2SO4溶液中加过量的氯化钡溶液,得到2.33g沉淀,原溶液中Na+的物质的量浓度为
A.1.0mol/L
B.2.0mol/L
C.0.50mol/L
D.0.025mol/L
参考答案:A
本题解析:分析:Na2SO4溶液中加过量的氯化钡溶液发生SO42-+Ba2+═BaSO4↓,2.33g沉淀为硫酸钡,利用离子方程式可计算硫酸根离子的物质的量,在利用化学式可判断Na+的物质的量,然后计算其浓度.
解答:氯化钡溶液过量,则2.33g沉淀为硫酸钡的质量,其物质的量为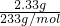 =0.01mol,
=0.01mol,
设Na2SO4的物质的量为x,则
SO42-+Ba2+═BaSO4↓,
?1?????????? 1
?x?????????? 0.01mol
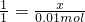 ,解得x=0.01mol,
,解得x=0.01mol,
则Na+的物质的量为0.1mol×2=0.02mol,
原溶液中Na+的物质的量浓度为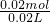 =1.0mol/L,
=1.0mol/L,
故选A.
点评:本题考查学生利用离子反应方程式的计算,明确沉淀质量为硫酸钡质量,利用离子反应可计算硫酸根离子的物质的量是解答本题的关键.
本题难度:困难
5、选择题 25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) ="=" 2H2O(1)△H=
参考答案:
本题解析:
本题难度:一般