微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式书写正确的是[???? ]
A.NaHSO4=Na++H++SO42-(熔融态)
B.NaHCO3=Na++H++CO32-
C.CH3COOH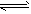 CH3COO-+H+
CH3COO-+H+
D.H2CO3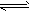 2H++CO32-
2H++CO32-
2、填空题 (8分)
Ⅰ.醋酸是常见的弱酸。用0.1 mol?L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol?L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。
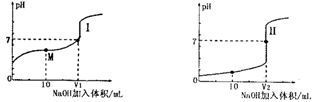
(1)滴定醋酸的曲线是 (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是 。
(3)V1和V2的关系:V1 V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4?2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。

(1)通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式: 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比 。
3、选择题 下列电离方程式错误的是?( )
A.Ca(OH)2=Ca2++2OH-
B.KClO3=K++Cl-+3O2-
C.BaSO4=B a2++SO42-
D.HNO3=H++NO3-
4、选择题 在室温下,下列叙述正确的是( )
A.将1 mL 1.0×10-5 mol/L盐酸稀释到1000 mL,得到pH=8 的盐酸
B.将1 mL pH=3的一元酸溶液稀释到10 mL,若溶液的pH<4,则此酸为弱酸
C.用pH=1的盐酸分别中和1 mL pH="13" NaOH溶液和氨水,NaOH消耗盐酸的体积大
D.pH=2的盐酸与pH=1的硫酸比较,2 c(Cl— )=c(SO42— )
5、填空题 (3分)物质的量浓度均为0.1mol/L的下列溶液:①KNO3 、②Na2CO3 、③NaHCO3 、④NaHSO4 、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2 ,pH由大到小的顺序为: 。