微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2═2H2O.试回答下列问题:
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为______
②正极反应式为______
③工作一段时间后,溶液pH______(填“增大”或“减小”或“不变”)
(2)如把KOH改为稀H2SO4作电解质,则:
①负极反应式为______
②正极反应式为______
③工作一段时间后,溶液pH______(填“增大”或“减小”或“不变”).
(3)如把H2改为甲烷,KOH作电解质,则正极反应式为______.
2、填空题 氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:
(1) 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,此反应中B元素的化合价没有发生变化,则NaBH4中H的化合价为___________,该反应氧化产物是______________,还原产物是______________。
(2) 有下列三个反应:
①Cl2+FeI2=FeCl2+I2 ;②2Fe2++Br2=2Fe3++2Br-;③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
①根据以上方程式可以得到Fe2+、Co2+、Br-、I-还原性由强的弱的顺序为_________;
②1molCo2O3能氧化HCl的物质的量_____________。
(3) 完成并配平下列化学反应方程式:
□KMnO4+□H2C2O4+□________ □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
(4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2H+ +Zn=Zn2++H2↑,可拆写为氧化反应式:Zn-2e-=Zn 2+,还原反应式:2H++ 2e-=H2↑。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
①将2Fe3++Cu= 2Fe2+ +Cu2+拆写为两个“半反应式”:其中,氧化反应式为 。
②由①中的反应,可设计成如右图所示的原电池:
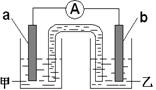
若电极a为Cu ,电解质溶液甲的化学式为 ;
电极b处的电极反应式为 。
3、选择题 如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是

A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
4、选择题 如图所示装置能使反应Zn+H2SO4=ZnSO4+H2↑的氧化反应和还原反应分别在锌片和铜片上进行,所以电流计指针发生了偏转。下列说法不正确的是
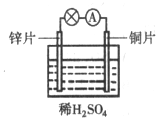
A.锌片发生氧化反应
B.铜片上有气体产生
C.电子由铜片通过导线流向锌片
D.铜片上发生反应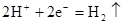
5、填空题 (7分)选择适宜的材料和试剂设计一个原电池,完成下列反应:
Zn + CuSO4 = ZnSO4 + Cu(1)注明电极材料和电解质溶液各是什么?
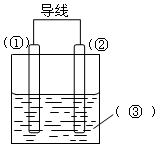
(2)写出电极反应式:
正极:?????????????????????????????;
负极:?????????????????????????????。