微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
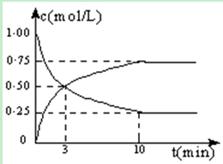
(1)从反应开始到第10min,H2的转化率为 ,在 该条件下,反应的平衡常数K= ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡 (选填序号)。
a.向正向移动 b.向逆向移动
c.不移动 d.无法确定平衡移动方向
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是 (选填序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
II.熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。请回答下列问题:
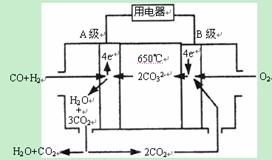
(1)A电极的电极反应方程式为 。
(2)常温下,用石墨作电极,以此电源电解一定量的CuSO4 溶液。当两极产生的气体体积相同时停止通电,若电解后溶液的体积为2L,溶液的pH=1(不考虑水解产生的H+),则阳极产生的气体的物质的量是 。
参考答案:
Ⅰ.(1) 90% , K=" 144" , a (
本题解析:
试题分析:Ⅰ.由图像判断CO2的浓度降低,CH3OH(g)的浓度增高; 容器的体积为2L
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
始量 2 5 0 0
转化量 1.5 4.5 1.5 1.5
平衡量 0.5 0.5 1.5 1.5
H2的转化率为4.5÷5=0.9
K=1.5/2×1.5/2÷(0.5/2 ×(0.5/2)3)=144
Qc=0.80×0.80÷(1.00×0.403)=10<144,故平衡正向移动。
(2)a升高温度平衡逆向移动,比值变小,错误;b恒容下充入He(g),平衡不移动,比值不变,错误;c分离出产物,平衡正向移动,比值变大,正确;d再充入CH3OH(g),其含量变高,比值变大,正确;
II.(1)A电极为负极,注意介质为碳酸盐, CO+H2-4e-+2CO32-=3CO2+H2O ;
(2)电解CuSO4 溶液,阳极产生氧气,阴极首先产生铜单质,后产生氢气,反应式为
阳极:4OH- + 4e- = O2↑+ 2H2O
阴极:Cu2+ + 2e- = Cu(先)
2H+ + 2e- = H2↑(后)
两极产生气体的量相等,根据电子守恒列式为4n-2n=0.1×2[阳极产生的H+ 减去阴极消耗的H+ 等于溶液中剩余H+ ] n=0.1mol
考点:考查化学平衡及电化学有关问题。
本题难度:困难
2、选择题 我国首创的海洋电池以铝板为负极,铂网为正,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为: ,下列说法不正确的是(?)
,下列说法不正确的是(?)
A.正极反应为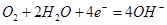
B.电池工作时电流由铝板沿导线流向铂电极
C.以网状的铂为正极,可增大氧气的接触面积
D.该电池只需更换铝板就继续使用
参考答案:B
本题解析:金属铝比铂活泼,所以铝是负极,失去电子,被氧化而溶解。根据总反应式可知,在正极上是溶解在水中的氧气得到电子,发生还原反应。在原电池中电子沿导线传递到正极上,所以正确的答案是B。
本题难度:一般
3、填空题 (8分)约6cm长,2cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm),将铜片与铝片分别和电流表的“+”、“–”端相连结,电流表指针调到中间位置,取50 mL两只小烧杯,在一只烧杯中注入40mL浓HNO3,另一只烧杯中注入40mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为______(填“铝”或“铜”)极,铝片上的电极反应式为:____________________________。
②两电极同时插入浓HNO3中,原电池的负极为_________(填“铝”或“铜”)极,铝片上的电极反应式为:_____________________________。
参考答案:(8分)每空各2分
铝,??? Al-3e-=Al3+
本题解析:(1)在电解质稀硫酸形成的原电池中,活性较强的铝为负极,失电子:Al-3e-=Al3+
(2)在电解质浓硝酸形成的原电池中,由于在常温下铝在浓硝酸中钝化,反而活性较差的铜失电子,做负极:Cu-2e-=Cul2+,溶液中的硝酸根离子在正极上得电子:NO3-+2H++e-=NO2+H2O
(可由总反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O减去负极反应面得到正极反应式)
本题难度:一般
4、填空题 能源与人类社会发展息息相关。请回答:
(1) 25℃、101 kPa时,H2(g)与O2(g)反应生成1 mol H2O(l),放出285.8 kJ的热量。写出该反应的热化学方程式:____。
(2)利用以上反应____(填“可以”或“不可以”)设计成原电池。
(3)电解NaCl溶液时,在____(填“阳极”或“阴极”)生成Cl2。
(4)铁制镀件上镀铜时,____作阳极。
参考答案:(1)2H2(g)+O2(g)==2H2O(l) △H=-5
本题解析:
本题难度:一般
5、选择题 图为番茄电池,下列说法正确的是
A.一段时间后,锌片质量会变小
B.一段时间后,铜片质量会变小
C.电子由铜通过导线流向锌
D.锌电极是该电池的正极

参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的氢离子在正极得到电子,答案选A。
本题难度:一般