微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知下列热化学方程式
2H2(g)+O2(g)=2H2O(1) △H= -571.6KJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H =" -890.3" kJ/mol
1 g 氢气和1 g 甲烷分别燃烧后,放出的热量之比最接近
A.1 : 3.4
B.1 : 1.7
C.2.3 : 1
D.4.6 : 1
参考答案:C
本题解析:
试题分析:1 g 氢气燃烧放出的热量是571.6KJ/4="142.9kJ,1" g 甲烷燃烧放出的热量是890.3 kJ/16=55.6kJ,两者之比为2.6:1最接近2.3:1,答案选C。
考点:燃烧热的计算
本题难度:一般
2、填空题 光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为?890.3kJ?mol?1、?285. 8 kJ?mol?1和?283.0 kJ?mol?1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):

①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5?6min和15?16 min时平均反应速率的大小:v(5?6)
v(15?16)(填“<”、“>”或“=”),原因是 。
③计算反应在第8 min时的平衡常数K= ;(列出计算过程,结果保留两位小数)
参考答案:(1) CHCl3+H2O2 本题解析:
本题解析:
试题分析:(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,根据元素守恒可知产物还应有HCl和水,故方程式为CHCl3+H2O2 HCl+H2O+COCl2;(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol-1;②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol-1。(3)①第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动.4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,又因为正反应为吸热反应,所以T(2)<T(8);②在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16);③由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,故该温度下K=
HCl+H2O+COCl2;(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol-1;②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol-1。(3)①第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动.4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,又因为正反应为吸热反应,所以T(2)<T(8);②在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16);③由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,故该温度下K=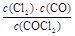 =
=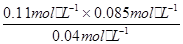 =0.23 mol·L-1。
=0.23 mol·L-1。
考点:考查热化学方程式、化学反应速率、化学平衡常数等相关知识。
本题难度:困难
3、填空题 Ⅰ(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,表示H2燃烧热的热化学方程式________________________________。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的反应热为_____________________,表示其中和热的热化学方程式为________________________ _。
Ⅱ:NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为2CO+2NO=N2+2CO2,为了控制大气污染,提出下列建议:
A.使用催化剂 B.改变压强 C.提高反应温度
你认为可行的方法是 ,理由是
参考答案:Ⅰ:(1)H2(g)+1/2O2(g)=H2O(l) △H=
本题解析:Ⅰ(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以表示氢气燃烧热的热化学方程式是H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol。
(2)放出114.6kJ的热量,所以该反应的反应热△H=-114.6kJ/mol;中和热是在一定条件下,稀溶液中,酸和碱反应生成1mol水时所放出的热量,所以热化学方程式是NaOH(ag)+1/2H2SO4(ag)=1/2Na2SO4(ag)+H2O(l) △H=-57.3kJ/mol。
Ⅱ。由于催化剂能够降低反应的活化能,成千上万倍提高反应速率,使得缓慢发生的2CO+2NO=N2+2CO2反应迅速进行。给导出的汽车尾气再加压、升温的想法不合乎实际,因此正确的答案选A。
本题难度:一般
4、选择题 已知:H2(g)+F2(g)=2HF(g) △H=-270kJ/mol,下列说法正确的是[???? ]
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ热量
参考答案:C
本题解析:
本题难度:一般
5、填空题 (14分)钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题:
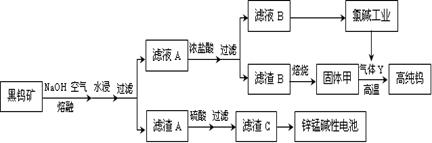
(1)上述流程中通入空气的目的是 ;
(2)滤渣A与硫酸反应的离子方程式为 ;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图:
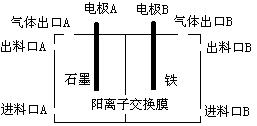
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中电极 (填“A”或“B”)相接,气体Y为气体出口 (填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为 ,写出锌锰碱性电池正极反应式 ;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因 ;
(5)将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
参考答案:(14分)
⑴ 氧化Fe2+、Mn2+(2分)
本题解析:
试题分析:(1)因为锌锰碱性电池中含有二氧化锰,所以通入空气的目的是氧化Fe2+、Mn2+,使其转化为Fe3+、Mn4+;
(2)因为亚铁离子被氧化为铁离子,与氢氧化钠反应生成氢氧化铁沉淀,在加热条件下,最终转化为氧化铁或四氧化三铁,所以滤渣A与稀硫酸反应实质是氧化铁与稀硫酸反应,离子方程式是Fe2O3 + 6H+= 2Fe3+ + 3H2O 或 Fe3O4 + 8H+= 2Fe3++ Fe2++ 4H2O;
(3)碱性锌锰电池的Zn发生氧化反应,作原电池的负极,滤液A与盐酸反应生成钨酸沉淀,焙烧分解生成WO3,氯碱工业中产生的气体有氢气和氯气,而氢气可还原WO3为W,氢气在负极产生,而Fe不能做阳极,所以Fe极为阴极,所以锌锰碱性电池的锌电极应与装置中电极B相连,则氢气在B口出来的气体;为增强溶液的导电性,在进料口B处加入稀NaOH溶液;碱性锌锰电池的正极发生还原反应,二氧化锰得到电子生成MnOOH,电极反应式为MnO2 + e-+ H2O =" MnOOH" + OH-;
(4)若用碳单质还原WO3,则W中可能含有C单质,而用氢气还原,则不会产生杂质;
(5)利用盖斯定律将氧气消去,所以CO2(g)与H2(g)反应生成CH4(g)与液态水的反应热ΔH=4ΔH2-ΔH1=-252.9kJ/mol,所以CO2(g)与H2(g)反应生成CH4(g)与液态水的的热化学方程式是CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH=-252.9kJ/mol。
考点:考查工业流程的分析,电化学反应原理的应用,盖斯定律的应用
本题难度:困难