微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)X、Y、Z、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次个层电子少数2,W的内层电子已充满,最外层只有一个电子。请回答:
(1)X元素在周期表中的位置是 ;W2+离子的核外电子排布式
(2)Y离子和Z离子比较,半径较大的是 (写离子符号),Z元素和氧元素的简单气态氢化物沸点不同的原因是
(3)Z元素的非金属性比 强,可由一复分解反应推测而得,其反应的化学方程式为
(4)X单质易溶于X与Z形成的三原子化合物中,该化合物分子中的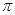 键与
键与 键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
(5)用H2O2和Z元素最高价氧化物对应水化物的混合溶液可溶解W单质粉末,已知:
①W(s)+2H+(aq)=W2+(aq)+H2(g) ?H=-64.39KJ/mol
②2H2O2(l)=2H2O(l)+O2(g)?H=-196.46KJ/mol
③H2(g)+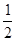 O2(g)= H2O(l) ?H=" -285.84" KJ/mol
O2(g)= H2O(l) ?H=" -285.84" KJ/mol
则在Z元素最高价氧化物对应水化物的溶液中,W与H2O2反应生成W2+与H2O的热反应化学方程式为
参考答案:(1)第二周期第ⅣA族
本题解析:
试题分析:X元素原子核外有三个能级,各能级电子数相等,则X 是C元素;Y的单质在空气中燃烧生成一种淡黄色的固体,则Y是Na元素;Z元素原子的最外层电子数比次个层电子少数2,则Z是S元素;W的内层电子已充满,最外层只有一个电子,则Z是Cu元素。(1)X元素在周期表中的位置是第二周期第ⅣA族;29号元素Cu的离子的核外电子排布式是[Ar]3d9;(2)Y离子和Z离子比较,前者是2、8的电子层结构,后者是2、8、8的电子层结构,离子核外电子层数越多,离子半径越大,所以两种离子中半径较大的是S2-;H2O、H2S都是分子晶体,分子间通过分子间作用力结合,而水的分子之间除了分子间作用力外,还存在氢键,增加了分子之间的作用力,所以水的熔沸点比H2S高。(3)Z元素的非金属性比X强,这可以根据元素的最高价氧化物对应的水化物的酸性强弱比较,用方程式表示是:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;(4)X与Z形成的三原子化合物CS2是共价化合物,结构类型CO2,结构式是S=C=S,该化合物分子中的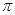 键与
键与 键的个数之比是2:2=1:1;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为HCO3—+OH—=CO32—+H2O;(5)①+②÷2+③,整理可得:Cu(s)+H2O2(l)+2H+(aq)=Cu2+ (aq)+2H2O(l) △H=-319.68kJ/mol。
键的个数之比是2:2=1:1;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为HCO3—+OH—=CO32—+H2O;(5)①+②÷2+③,整理可得:Cu(s)+H2O2(l)+2H+(aq)=Cu2+ (aq)+2H2O(l) △H=-319.68kJ/mol。
考点:考查元素的推断、元素在周期表中的位置、核外电子排布、离子半径比较、氢键、元素非金属性的比较、物质分子中化学键、反应的离子方程式和热化学方程式的知识。
本题难度:困难
2、选择题 已知:H2(g)+F2(g)=2HF(g) △H=-270kJ/mol,下列说法正确的是[???? ]
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ热量
参考答案:C
本题解析:
本题难度:一般
3、选择题 已知反应:H2(g) + 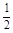 O2(g) = H2O(g) △H1
O2(g) = H2O(g) △H1
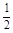 N2(g) + O2(g) = NO2 (g) △H2
N2(g) + O2(g) = NO2 (g) △H2
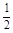 N2(g) +
N2(g) + 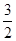 H2(g) = NH3 (g) △H3
H2(g) = NH3 (g) △H3
则反应2NH3 (g) +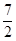 O2(g) =2NO2 (g) +3H2O(g) 的△H=
O2(g) =2NO2 (g) +3H2O(g) 的△H=
A.2△H1+2△H2—2△H3
B.△H1+△H2—△H3
C.3△H1+2△H2+2△H3
D.3△H1+2△H2—2△H3
参考答案:D
本题解析:
试题分析:方程式①×3+②×2-③×2得到反应2NH3 (g) +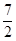 O2(g) =2NO2 (g) +3H2O(g) ,所以该反应的△H=3△H1+2△H2—2△H3。
O2(g) =2NO2 (g) +3H2O(g) ,所以该反应的△H=3△H1+2△H2—2△H3。
考点:考查盖斯定律的应用有关问题。
本题难度:一般
4、选择题 在298 K、100 kPa时,已知:
Cl2(g)+H2(g)===2HCl(g) ΔH1 2H2O(g)===2H2(g)+O2(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH2和ΔH1之间的关系正确的是
A.ΔH3=2ΔH1-ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=2ΔH1+ΔH2
D.ΔH3=ΔH2-ΔH1
参考答案:C
本题解析:
试题分析:根据盖斯定律,将Cl2(g)+H2(g)===2HCl(g) 的2倍与 2H2O(g)===2H2(g)+O2(g) 相加即可得到2Cl2(g)+2H2O(g)===4HCl(g)+O2(g),所以ΔH3=2ΔH1+ΔH2,答案选 C。
考点:考查盖斯定律的应用
本题难度:一般
5、选择题 已知:

C3H8(g)+5O2(g)===3CO2(g)+4H2O(1) △H1
H2O(1)=H2O(g) △H2
C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) △H3
则三反应热之间的关系正确的是( )
参考答案:A
本题解析:根据盖斯定律可知,①+②×4即得到C3H8(g)+5O2(g)===3CO2(g)+4H2O(g),所以
本题难度:一般