微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H 1=" -" 90.7 kJ·mol-1
CH3OH(g) △H 1=" -" 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3 =" -" 41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =" -" 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是 。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为 。
(4)图为绿色电“二甲醚燃料电池”的工作原理示意图。
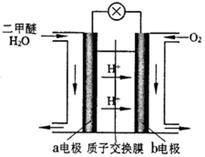
该电池工作时,H+向 极移动(填“正”或“负”);a电极的电极反应式为 。
参考答案:(1)-246.1KJ/mol,提高化学反应速率;(2)逆向
本题解析:
试题分析:(1)①×2+②+③,整理可得3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
△H=2△H 1+△H2 +△H3 =-246.1KJ/mol;由于该反应的正反应是放热反应,所以若要采用很高的温度,反应物的转化率 降低,之所以在催化反应室中采用300℃的反应温度,是为了提高化学反应速率,缩短达到平衡所需要的时间;(2)各种物质的浓度分别是:c(CO)=1mol/L; c(H2)="1.5mol/L;" c(CH3OH)=1mol/L.由于Q=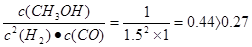 ,所以此时反应将逆向进行;(3)在上述反应过程中制取的物质中除了含有二甲醚外,还含有甲醇、CO、CO2、水蒸气,所以制取流程中二甲醚精制的实验操作名称为蒸馏;(4)在绿色电“二甲醚燃料电池”工作时,H+向负电荷较多的正极极移动;负极a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+。
,所以此时反应将逆向进行;(3)在上述反应过程中制取的物质中除了含有二甲醚外,还含有甲醇、CO、CO2、水蒸气,所以制取流程中二甲醚精制的实验操作名称为蒸馏;(4)在绿色电“二甲醚燃料电池”工作时,H+向负电荷较多的正极极移动;负极a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+。
考点:考查盖斯定律的应用、反应热效应的判断、化学反应进行的方向的判断、混合物的分离方法、燃料电池 的电极反应式的书写的知识。
本题难度:困难
2、填空题 氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨.下图是合成氨的简要流程.
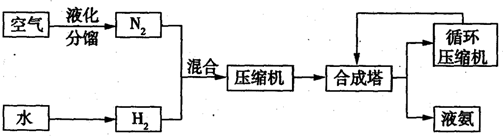
(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是______.
| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气
沸点/℃
-196
-183
-269
-264
-186
-153
-108
(2)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤
相对投资费用
1.0
1.5
2.0
能量消耗/J-t-1
28×109
38×109
48×109
①依据上表信息,你认为采用______为原料最好.
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:______.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ-mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ-mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ-mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式______.
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
NH3含量%
压强/MPa
温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100
200
15.3
81.5
86.4
89.9
95.4
98.8
300
2.2
52.0
64.2
71.0
84.2
92.6
400
0.4
25.1
38.2
47.0
65.2
79.8
500
0.1
10.6
19.1
26.4
42.2
57.5
600
0.05
4.5
9.1
13.8
23.1
31.4
①依据表中数据判断,合成氨反应N2+3H2

2NH3的△H______(填“>”、“<”或“无法判断”)0,请简要说明理由______;
②该反应的化学平衡常数表达式为______.
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的______倍.
参考答案:(1)液态气体升高温度时,氦气沸点最低,先变为气体,故答案为
本题解析:
本题难度:一般
3、填空题 (14分)四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍。

请用化学用语回答:
(1)丙在元素周期表中的位置___________________________
(2)丁单质的电子式___________________________________
(3)乙的两种常见单质分别是__________,_______________
(4)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)________,________
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)__________。此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式_________________
(6)电解丁的钠盐饱和溶液的离子方程式________________________________
(7)若甲的元素符号为X。已知①X2(g)+2O2(g)==X2O4(l) △H="-19.5KJ/mol" ②X2H4(l)+O2(g)==X2(g)+2H2O(g) △H=-534.2KJ/mol则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式为______________________________________________________
参考答案:(1)第三周期第ⅥA族;(2) 本题解析: 本题解析:
试题分析:乙元素原子核外最外层电子数是其电子层的三倍,且乙是短周期元素,即乙:O,根据它们在元素周期表的位置,丙:S,丁:Cl,甲:N,(1)S在周期表的位置第三周期第ⅥA族;(2)丁是Cl,其单质是Cl2,则电子式: ;(3)根据推断乙为O,两种常见的单质分别是O2、O3;(4)甲乙丙丁的气态氢化物分别是:NH3、H2O、H2S、HCl,其中NH3的水溶液显碱性,H2S、HCl水溶液显酸性,H2O显中性,符合题意的是:H2S、HCl;(5)氧和氢组成的化合物常见的有两种H2O、H2O2,其结构简式分别是: ;(3)根据推断乙为O,两种常见的单质分别是O2、O3;(4)甲乙丙丁的气态氢化物分别是:NH3、H2O、H2S、HCl,其中NH3的水溶液显碱性,H2S、HCl水溶液显酸性,H2O显中性,符合题意的是:H2S、HCl;(5)氧和氢组成的化合物常见的有两种H2O、H2O2,其结构简式分别是: (只含极性共价键)、 (只含极性共价键)、 (含有极性共价键、非极性共价键),符合题意的是:H2O2,根据题干发生反应:H2O2+CN-→NH3+CO32-,H2O2中的O-1→-2共↓2,CN-中C+2→+4↑2,反应过程中发现反应物中少了1个O,1个H,电荷反应物中少了-1价,即缺少1个氢氧根,H2O2+CN-+OH-=NH3+CO32-;(6)电解的是饱和食盐水,根据阴阳离子的放电顺序,阴极:2H2O+2e-=H2↑+2OH-,阳极:2Cl--2e-=Cl2↑,两者相加得:Cl-+2H2O (含有极性共价键、非极性共价键),符合题意的是:H2O2,根据题干发生反应:H2O2+CN-→NH3+CO32-,H2O2中的O-1→-2共↓2,CN-中C+2→+4↑2,反应过程中发现反应物中少了1个O,1个H,电荷反应物中少了-1价,即缺少1个氢氧根,H2O2+CN-+OH-=NH3+CO32-;(6)电解的是饱和食盐水,根据阴阳离子的放电顺序,阴极:2H2O+2e-=H2↑+2OH-,阳极:2Cl--2e-=Cl2↑,两者相加得:Cl-+2H2O Cl2↑+H2↑+2OH-;(7)②×2-①得:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=-534.2×2+19.5kJ·mol-1=-1048.9kJ·mol-1。 Cl2↑+H2↑+2OH-;(7)②×2-①得:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=-534.2×2+19.5kJ·mol-1=-1048.9kJ·mol-1。
考点:考查元素周期表、元素及其化合物的性质、氧化还原反应、电解、热化学反应方程式等知识。
本题难度:困难
4、选择题 已知热化学方程式:SO2(g)+ 1/2O2(g) 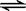 SO3(g) △H = SO3(g) △H =
参考答案:
本题解析:
本题难度:一般
5、填空题 (16分)I.一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。 FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
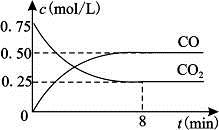
(1)8分钟内,CO的平均反应速率v(CO)=___________(结果保留3位有效数字)。
(2)1100℃时该反应的平衡常数K= (填数值);该温度下,若在8分钟时CO2和CO各增加0.5mol/L,此时平衡 移动(填“正向”、“逆向”或“不”)。
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|