1.67
?
(4)通过表格中的数值可以推断:反应①的△H_??O。(填“>”“<”)
(5)现有反应③:该反应的平衡常数的数学表
达式K3=____。
(6)根据反应①和②可以推导出Ki,Kz和玛之间的关系式。K3=__________。据此关系式和上表数据,也能推断出反应③的△H_?????_0(填“>”“<”)。
参考答案:(14分)
(1)0.006????(2分)
(
本题解析:I.⑴在1000℃时,该反应的平衡常数K=64,在10L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) 2Fe(s)+3CO2(g)
起始量(mol) 1???????? 1??????????? 1???????? 1
变化量(mol)??
本题难度:一般
3、填空题 分解水制氢气的工业制法之一是硫——碘循环,主要涉及下列反应:
I?? SO2+2H2O+I2→H2SO4+2HI?????????
II?? 2HI H2+I2 H2+I2
III? 2H2SO4 → 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是_________??
a.反应III易在常温下进行??????? b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O????????d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。
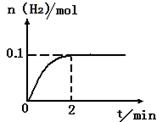
0—2min内的平均反应速率v(HI)= _________?。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。 H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
a.平衡常数??????????????????? b.HI的平衡浓度?
c.达到平衡的时间?????????????d.平衡时H2的体积分数
(3)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g) + O2(g)  2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号) 2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
 ? ?
实际工业生产使用的条件是:常压、____________________________________选择该条件的原因是__________________。
(4)实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为______________。
参考答案:(1)bc(2分)
(2)0.05mol·L-1·m
本题解析:
试题分析:(1)a.反应III2H2SO4 → 2SO2+O2+2H2O是分解反应,要在高温下进行。b.根据还原剂的还原性强于还原产物的还原性,故反应I中SO2还原性比HI强,正确。c.水在循环过程中始终消耗,故需补充H2O,正确。d.根据电子守恒,循环过程中产生1molO2转移4mol电子,同时产生2molH2,错误。故选bc。
(2)根据平均反应速率v(HI)="2v(H2)=2*0.1/(2*2" )= 0.05mol·L-1·min-。该温度下,反应2HI(g) 本题难度:困难 本题难度:困难
4、选择题 某恒温密闭容器发生可逆反应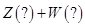  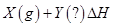 ,在 ,在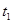 时刻反应达到平衡,在 时刻反应达到平衡,在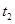 时刻缩小容器体积, 时刻缩小容器体积,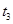 时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是 时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
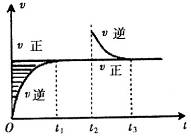
A.Z和W在该条件下至少有一个是为气态
B. 时间段与 时间段与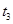 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则 时间段与 时间段与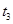 时刻后的X浓度不相等 时刻后的X浓度不相等
D.若该反应只在某温度 以上自发进行,则该反应的平衡常K随温度升高而增大 以上自发进行,则该反应的平衡常K随温度升高而增大
参考答案:D
本题解析:
试题分析:A、根据图象可知,正反应速率不随反应时间和压强的改变而改变,故Z和W都是不是气体,故A错误;B、结合图象可知,只有X是气体,所以反应过程中气体的摩尔质量始终不变,故B错误;C、由于化学平衡常数只与温度有关,该温度下平衡常数的表达式K=c(X)是定值,则t1~t2时间段与t3时刻后的c(X)相等,故C错误;D、由于该反应在温度为T0以上时才能自发进行,根据△H-T△S<0,得出该反应是吸热反应,升高温度平衡正向移动,平衡常数增大,故D正确;
本题难度:一般
5、填空题 已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) 4NO(g)+6H2O(g)
(1)下列能说明该反应已经达到平衡状态的是???????????;
A.容器中气体总质量不变
B.c(O2)不变
C.υ(O2)=1.25υ(NH3)
D.体系压强不变
E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)向该容器中加入正催化剂,则反应速率?????(选填“增大”、“减小”、“不变”,下同),降低容器的温度则反应速率????,通入Ar,则反应速率????。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是?????????????。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
参考答案:(11分)(1)BDE????????????(2)增大;减
本题解析:
试题分析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B正确。化学反应中一定满足质量质量守恒定律,A不能说明。速率之比是相应的化学计量数之比,因此C中的关系始终是成立,不正确。该反应是体积增大的可逆反应,则当压强不再发生变化时可以说明,D正确;E中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,因此答案选BDE。
(2)催化剂能增大反应速率,而降低温度则减小反应速率。通入
本题难度:一般
|