微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 27克的CuCl2的物质的量为多少?Cu2+和Cl-的物质的量为多少?
参考答案:由n=mM
本题解析:
本题难度:一般
2、选择题 0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A.5
参考答案:
本题解析:
本题难度:简单
3、选择题 把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为
A. mol·L-1
mol·L-1
B. mol·L-1
mol·L-1
C.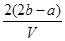 mol·L-1
mol·L-1
D. mol·L-1
mol·L-1
参考答案:C
本题解析:
试题分析:设每份中镁离子的物质的量为x,硫酸根离子的物质的量为y,则由
Mg2++2OH-=Mg(OH)2↓可知,
1 2
x amol
解得x=0.5amol
由Ba2++SO42-=BaSO4↓可知
1 1
bmol y
解得y=bmol
忽略溶液中的H+和OH-由电荷守恒知
溶液中K+的物质的量为(b-0.5a)×2mol=(2b-a)mol
又由于混合溶液分成两等份,则原溶液中的K+的物质的量为2(2b-a)mol
则原混合溶液中钾离子的浓度为 mol·L-1,所以答案选D。
mol·L-1,所以答案选D。
考点:考查溶液中根据方程式进行的离子浓度的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,侧重对学生能力的培养。该题的关键是明确信息中恰好使离子转化为沉淀,然后利用离子之间的反应、电荷守恒、物质的量浓度的计算即可解答。
本题难度:一般
4、选择题 CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为(???)
A.25%
B.75%
C.88%
D.32%
参考答案:C
本题解析:
试题分析:设CO2和氢气的物质的量分别是x和y,则44x+2y=5g。氢气燃烧生成水,水和过氧化钠反应又生成氢氧化钠和氧气,反应的方程式可以看作是H2+Na2O2=2NaOH,所以该题增加的质量就是氢气的质量。根据方程式可知
2CO2+2Na2O2=2Na2CO3+O2?????△m↑
2mol??????????????????????? 56g
X?????????????????????????? 28x
所以28x+2y=3.4g
解得x=0.1mol
本题难度:一般
5、实验题 用18 mol/L的硫酸溶液配制500 mL1 mol/L的硫酸溶液,有下列操作步骤:
(1)将溶解后的硫酸溶液立即沿玻璃棒转入容量瓶中;
(2)将量得的浓硫酸倒入烧杯中,加水溶解,然后用蒸馏水洗涤量筒2~3次,倒入烧杯中;
(3)盖上瓶塞,轻轻摇匀即配制完毕;
(4)洗涤烧杯和玻璃棒2~3次,将洗涤液全部转入容量瓶中,加水至离刻度1~2 cm处,改用胶头滴管加水至刻度线;
(5)用量筒量取27. 78 mL的浓硫酸。
先将以上步骤按实际操作的先后顺序排列,_________指出操作中所有的错误和不妥之处____________。
参考答案:(5)(2)(1)(4)(3);
操作中的错误可按操作
本题解析:
本题难度:一般