微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室用2.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。
(1)配制上述溶液,需要2.0 mol/L NaCl溶液 mL。
(2)配制上述溶液除需要玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、量筒、 __________________。20g NaOH固体溶解 后配制成100mL溶液,其溶质物质的量为 ,取出10mL该溶液,它的物质的量浓度为 。
(3)在配制过程中,其它操作都正确,下列操作中,能引起浓度偏高的有 (填代号): ①
② 定容时加蒸馏水超过刻度线,又用胶头滴管吸出
②转移溶液前,容量瓶中含有少量 水
③定容摇匀后发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线
参考答案:(5分)(1)25 mL (2)100ml容量瓶;
本题解析:
试题分析:(1)在氯化钠的稀释过程中,溶质是不变的,所以需要氯化钠溶液的体积是 。
。
(2)根据所给的仪器可知,还缺少100ml容量瓶。20g NaOH固体的物质的量是20g÷40g/mol=0.5mol,则其浓度是0.5mol÷0.1L=5mol/L。
(3)根据n=c·V可知,如果定容时加蒸馏水超过刻度线,又用胶头滴管吸出,则溶质减少,浓度偏低;转移溶液前,容量瓶中含有少量水,溶质和溶液的体积不变,浓度不变;定容摇匀后发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,则溶液体积增加,浓度偏低;定容时,俯视刻度线,则溶液体积减少,浓度偏高,答案选④。
考点:考查一定物质的量浓度溶液的配制和计算
点评:该题是中等难度的试题,试题在考查基础知识的同时,侧重能力的培养的解题方法指导,有助于培养学生的逻辑思维能力。该题的难点在于误差分析,该题学生需要明确配制物质的量浓度溶液时,要注意根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。
本题难度:一般
2、填空题 (6分)某学生为了测定由两种元素形成的气态化合物X的组成,进行了如图所示的实验,将装置内空气排尽后,把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应(气态化合物X与CuO均无剩余),得到如下结果:
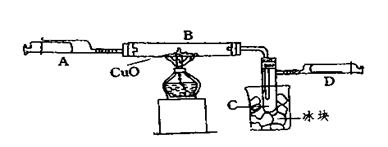
①实验前B管及药品的质量为21.32克,实验后为21.16克
②C管中收集到的物质电解后可得到H2和O2,在D中收集到的是N2。
③X中两元素的质量比是14:3。问:
(1)C中收集到的液体,物质的量是 mol;
(2)在实验中看到的现象是 。
(3)B中反应的化学方程式是 。
参考答案:(1)0.01mol; (2)黑色固体逐渐变为红
本题解析:
试题分析:(1)“D中收集到的是N2”,“C管中收集到的物质电解后可得到H2和O2”,根据这两个信息知道X中含有N、H两中元素,C是H2O,又有“X中两元素的质量比是14:3” 则可得氮、氧两种元素的原子个数比为1:3.所以X化学式为NH3; “由实验前B管及药品的质量为21.32g,实验后为21.16g”,可知B管质量减少了0.16g;减少的是O元素的质量,n(O)= 0.16g÷16g/mol="0.01mol" ,则收集到的水的物质的量为0.01mol;(2)根据以上分析知道氧化铜与氨气反应生成铜和水和氮气.所以现象为黑色固体逐渐变为红色,C管中生成水,冷却后变为无色液体,产生氮气,压强增大,注射器的内管向外推动;(3)根据以上分析,反应物为NH3和CuO,生成物为Cu、N2和H2O,则化学方程为:2NH3+3CuO 3Cu十N2↑+3H2O
3Cu十N2↑+3H2O
考点:物质组成的推测、实验现象的描述和物质的量的有关计算。。
本题难度:一般
3、选择题 将溶质A的质量分数为5X%和X%的两种溶液等体积混合,所得溶液中A的质量分数小于3X%,则A可能是 ( )
①H2SO4 ②C2H5OH ③NH3 ④CH3COOH ⑤NaOH
A.①⑤
B.①④⑤
C.②③
D.②③④
参考答案:C
本题解析:若溶液的密度大于水的密度,当质量分数不同的同种溶质溶液等体积混合,混合后溶液的质量分数将大于两质量分数和的一半;若溶液的密度小于水的密度,当质量分数不同的同种溶质溶液等体积混合,混合后溶液的质量分数将小于两质量分数和的一半;
中学化学中,溶液的密度比水小的主要是指氨水、酒精;其他溶液一般密度都比水大;
本题难度:困难
4、计算题 某温度下22%的NaNO3溶液150mL,加100g水稀释后浓度变成14%,求原150mL溶液中NaNO3的物质的量浓度。
参考答案:设原NaNO3溶液的质量为x。 根据加水前后NaNO3质量不
本题解析:
本题难度:一般
5、计算题 (8分)标准状况下11.2 L HCl溶于水形成500 mL 溶液。
(1)所得盐酸的物质的量浓度为 ;
(2)向其中加入 g NaOH才能中和完全;
(3)若不考虑加入NaOH对体积造成的影响,所得NaCl的物质的量浓度为 ;
(4)再向其中加入 mL 密度为1.7 g/cm3,质量分数为25%的AgNO3溶液可使Cl-完全沉淀。
参考答案:(1)1 mol/L (2)20 (3)1 mol/L (4
本题解析:(1)c(HCl)=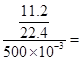 1 mol/L
1 mol/L
(2)HCl+NaOH=NaCl+H2O,所需NaOH为:0.5×40=20g
(3)c(HCl)=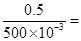 1 mol/L
1 mol/L
(4)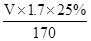 =0.5可知V="200" ml
=0.5可知V="200" ml
本题难度:一般