微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO
电离平衡常数
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
3.0×10-8
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa? d.NaHCO3;pH由大到小的顺序是:______;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:______;
A.c(H+)???B.c(H+)/c(CH3COOH)?C.c(H+)?c(OH-)??D.c(OH-)/c(H+)
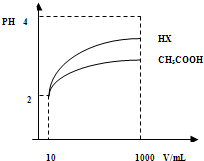
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是______,稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:______;
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO-)-c(Na+)=______.(填准确数值).
2、选择题 下列离子方程式正确的是(????)
A.亚硫酸钠与盐酸反应:Na2SO3+2H+===2Na2++SO2↑+ H2O
B.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
C.稀硫酸与锌反应:H2SO4+Zn=Zn2+ +SO42-+H2↑
D.硫酸溶液与氢氧化钠溶液反应:H++ OH-==H2O
3、选择题 中和相同体积、相同pH的 NaOH、Ba(OH)2、NH3·H2O三种溶液,所用相同浓度HCl溶液的体积依次分别是V1、V2、V3。则这三者的关系是[???? ]
A.V1 > V2 > V3
B.V1< V2 < V3
C.V1 = V2 > V3
D.V1 = V2 < V3
4、填空题 (16分)钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是???????(用离子方程式表示)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
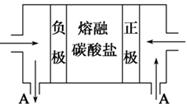
正极的电极反应式为???????,电池工作时物质A可循环使用,A物质的化学式为???????。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
溶质
| CH3COONa
| Na2CO3
| NaClO
| NaCN
| pH
| 8.8
| 11.6
| 10.3
| 11.1
上述盐溶液的阴离子中,结合H+能力最强的是???????,根据表中数据,浓度均为0.01 mol·L-1下列四种酸的溶液分别稀释100倍,pH变化最大的是???????(填序号)。
a.HCN???????? b.HClO??????????? c.CH3COOH????? d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为???????。
②已知几种离子开始沉淀时的pH如下表:
离子
| Fe2+
| Cu2+
| Mg2+
| pH
| 7.6
| 5.2
| 10.4
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,???????(填离子符号)先沉淀,Ksp[Fe(OH)2]???????Ksp[Mg(OH)2](填“>”、“=”或“<”)。
5、填空题 (4分)(1)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(2)在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH≒CH3COO-+H+???ΔH > 0
下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是?????????????????。
a.加入少量0.10 mol·L-1的稀盐酸??? b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1???????? d.加入少量冰醋酸
e.加入少量氯化钠固体?????????????? f.加入少量0.10 mol·L-1的NaOH溶液
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772