微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250~300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下:
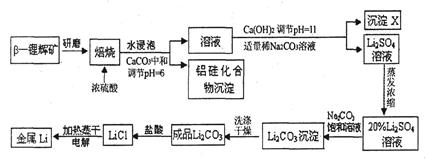
(1)用氧化物形式表示LiAlSi2O6的组成:___________________。
(2)沉淀X的主要成分是(写化学式)________________________。
(3)流程中两次使用了N a2CO3溶液,试说明前后浓度不同的原因:
a2CO3溶液,试说明前后浓度不同的原因:
____________________________________________________________________。
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:_____________________________________。
(5)将盐酸与Li2C03完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是__________________________________________。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
2、填空题 (1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
实验编号
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01)
②该反应为 (填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为 。
(3)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa
| 2×105
| 5×105
| 1×106
| c(A)/mol·L-1
| 0.08
| 0.20
| 0.44
①当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
②当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K= 。⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为 mol/L 。(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
参考答案:(1)①5 C + 4
本题解析:
试题分析:(1)①反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C→CO2,碳元素化合价由0价升高为+4,共升高4价,化合价最小公倍数为20,故MnO4-系数为4,C系数为5,再根据元素守恒可知Mn2+系数为4、CO2系数为5,根据电荷守恒可知H+系数为12,根据氢元素守恒可知H2O系数为6,配平后离子方程式为5 C + 4 MnO4- + 12 H+ ="=" 5 CO2↑+ 4 Mn2+ + 6 H2O,答案:5 C + 4 MnO4- + 12 H+ ="=" 5 CO2↑+ 4 Mn2+ + 6 H2O。
(2)①、由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=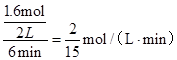 ,速率之比等于化学计量数之比,故v(CO2)=v(CO)= ,速率之比等于化学计量数之比,故v(CO2)=v(CO)=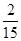 mol/(L·min)=0.13mol/(L·min), mol/(L·min)=0.13mol/(L·min),
故答案为:0.13mol/(L·min);
②、实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,
故答案为:放热;
平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g) CO2(g)+H2(g), CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
实验2中达平衡时 CO的转化率为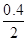 ×100%=20% ×100%=20%
答案:①0.13 mol·L-1 ·min-1; ② 放 ; 20%
(3) ①压强从2×105Pa增加到5×105 Pa时,A的浓度应变化为0.08mol·L-1的2.5倍即为0.20mol·L-1,而图表中变化为0.20mol·L-1,说明平衡不移动,加压时生成物A浓度增大的倍数等于压强增大的倍数;
②压强从2×105 Pa 增加到1×106 Pa时,A的浓度应变化为0.08mol·L-1的5倍即0.40mol·L-1,而图表中A的浓度为0.44mol·L-1,说明平衡逆向进行;根据①可知反应是气体体积增大的反应,所以此时B加压变为液体或固体,当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K=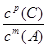
故答案为:①不; ② 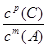 . .
(4 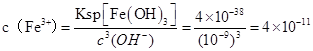 ,答案:4×10-11 ,答案:4×10-11
考点:氧化还原反应方程式的配平;氧化还原反应的计算,化学平衡的影响因素;化学平衡的计算
本题难度:困难
3、选择题 对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:1lP+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,下列关于该反应说法错误的是:
A.生成1 mol H3PO4时,有5 mol电子转移
B.5molCuSO4参加反应时,被氧化的P为1mol
C.氧化产物和还原产物的物质的量之比为6:5
D.6molH3PO4生成时,被CuSO4氧化的P为3mol
参考答案:B
本题解析:
试题分析:分析题给化学方程式知,P的化合价由反应前的0价变为反应后H3PO4中的+5价,及Cu3P中的—3价,铜元素的化合价由+2价降为+1价,P既是氧化剂又是还原剂,CuSO4是氧化剂,Cu3P 是还原产物,H3PO4是氧化产物,电子转移的数目为30;A、根据上述分析知,P的化合价由反应前的0价变为反应后H3PO4中的+5价,生成1 mol H3PO4时,有5 mol电子转移,正确; B、由题给反应知,5molCuSO4参加反应时,被氧化的P为2mol ,错误; C、由题给反应和上述分析知,氧化
本题难度:一般
4、填空题 金属钼(Mo)可以增强合金的某些机械性能和耐腐蚀性。下图是化工生产中制备金属铝的实验流程图(已知铝酸为难溶于水和酸的黄色晶体):

(1)在灼烧铝矿时发生化学反应: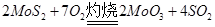 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
(2)步骤①中,灼烧钼矿时,用于盛放固体的仪器的名称为________。
(3)写出步骤②中发生反应的离子方程式_________________________________。
(4)在步骤③中需要加入过量硝酸,检验硝酸过量的操作为_________________。
(5)某同学拟选用如下装置,用氢气还原三氧化铝,同时检验该反应的氧化产物,根据要求回答下列问题。
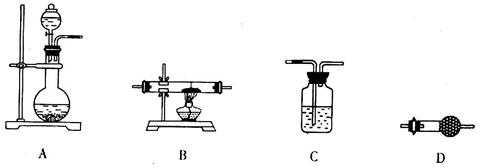
①若两次使用到C装置,则装置D中所盛的药品是________(填试剂名称)。
②根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞后______→______→______→______(请按正确的顺序填入下列步骤的代号)。
a.收集气体并检验其纯度???????? b.停止加热,充分冷却
c.加热反应一段时间???????????? d.关闭分液漏斗活塞,停止通氢气
参考答案:(1)MoS2(1分)? 14mol(2分)
(2)坩
本题解析:
试题分析:(1)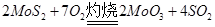 ,MoS2化合价升高为还原剂。1mol MoS2反应时,+4价Mo被氧化成+6价,-2价S被氧化成+4价 S,则失电子为14mol。 ,MoS2化合价升高为还原剂。1mol MoS2反应时,+4价Mo被氧化成+6价,-2价S被氧化成+4价 S,则失电子为14mol。
(2)步骤①中,灼烧使用的一起为坩埚。
(3)(4)见答案
(5)①该反应的氧化产物为水,用无水硫酸铜检验。
②见答案
本题难度:一般
5、选择题 在2KMnO4+16 HCl====2KCl+2MnCl2+5Cl2↑+8H2O的反应中,氧化剂和还原剂的物质的量之比为
A.1∶8
B.8∶1
C.1∶5
D.5∶1
参考答案:C
本题解析:高锰酸钾中锰的化合价从+7价降低到+2价,得到5个电子。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子。因此根据电子的得失守恒可知,氧化剂和还原剂的物质的量之比为1∶5 ,答案选C。
本题难度:一般
|
|