微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

A.1∶1∶1
B.1∶3∶1
C.3∶3∶8
D.1∶1∶4
参考答案:D
本题解析:解答本题应注意以下三点:(1)Fe与Fe(NO3)3、Cu(NO3)2、HNO3反应的先后顺序;(2)横、纵坐标及曲线各折点表示的意义;(3)HNO3反应生成的Fe3+和溶液中的原有Fe3+均与Fe发生反应。
本题难度:一般
2、选择题 部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是(? )。
A.滤液A中的阳离子为Fe3+、Fe2+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896
参考答案:B
本题解析:根据题意,3.2 g滤渣一定是铜,而铜与Fe3+不共存,则A项错误;最后的3.2 g固体为Fe2O3,其中Fe元素的质量为2.24 g,B正确;样品中Cu元素和O元素共5.76 g-2.24 g=3.52 g,则C项错误;因2.24 g Fe元素已部分氧化,且Fe还与Fe3+、Cu2+发生反应,故生成的氢气的体积应小于896 mL,D错误。
本题难度:一般
3、填空题 铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________________;
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________;
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
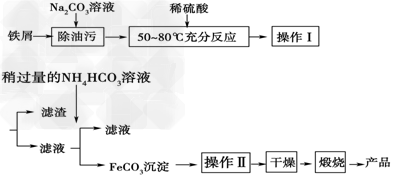
回答下列问题:
①操作Ⅰ的名称是________,操作Ⅱ的方法为__________________________________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)______________________;
③请完成生成FeCO3沉淀的离子方程式____________________________。
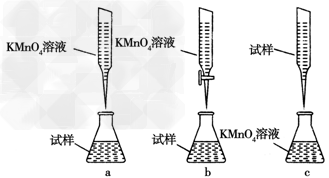
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250?mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需__________________________________。
②某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)
参考答案:(1)Fe2+、Fe3+、H+
(2)BC
(
本题解析:
本题难度:一般
4、选择题 将5.6g铁溶于足量稀盐酸中,再加入足量的氢氧化钠溶液,充分反应,过滤;在空气中加热所得滤渣,灼烧到质量不再变化,此时固体的质量为
A.7.2g
B.8.0g
C.9.0g
D.10.7g
参考答案:B
本题解析:
试题分析:5.6g铁的物质的量是5.6g÷556g/mol=0.1mol。铁与盐酸反应生成氯化亚铁和氢气,加热足量的氢氧化钠溶液后生成氢氧化亚铁白色沉淀。氢氧化亚铁不稳定,最终被转化为氢氧化铁。氢氧化铁受热分解生成氧化铁和水,所以根据铁原子守恒可知氧化铁的物质的量是0.1mol÷2=0.05mol,质量=0.05mol×160g/mol=8.0g,答案选B。
本题难度:一般
5、选择题 铁和铁的合金是生活中常用的材料,下列说法正确的是( )
A.一定条件下,铁粉可与水蒸气反应
B.不锈钢是铁的合金,只含金属元素
C.铁与盐酸反应,铁的合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
参考答案:A
本题解析:A 对,在高温下能反应
B 错不锈钢中还含有非金属元素碳元素
C 错 铁和铁的合金都可与盐酸反应
D 错 镀锌铁板,锌做负极,铁做正极,所以,镀锌铁板比铁板更耐腐蚀
本题难度:简单