微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 100毫升含HNO3、H2SO4的稀溶液中,加入9.6克铜充分反应,铜全溶,产生2.24升NO(标准状况)。同体积的混合酸恰好与250毫升2mol/L的NaOH完全中和。
计算原混合酸中HNO3的物质的量浓度的取值范围_________________________
H2SO4的物质的量浓度的取值范围_______________________。
2、计算题 取一定量的CuO粉末与0.5L稀硫酸充分反应后,将一根50g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24g. 并收集到224mL气体(标准状况)。求此CuO粉末的质量。
3、实验题 (15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:

棉球
| 棉球上滴加的试剂
| 实验现象
| 解释和结论
|
a
| ???????????????????
| 棉球变白,微热后又恢复红色
| ?????????????????????????????
|
b
| 含酚酞的NaOH溶液
| 棉球变为白色
| 离子方程式:????????????????????????????????
|
c
| ?
??????????????????
| 棉球变为白色
| 该气体具有????????????????(选填“氧化性”或“还原性”)
?
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。

实验一:铁矿石中含氧量的测定???
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,???????????????????????后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
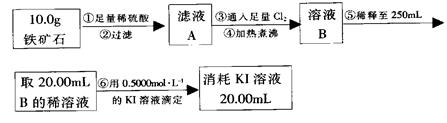
(1)步骤②和⑤中都要用到的玻璃仪器是?????????????__。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为???????
4、实验题 (12分)某氧化铁样品中含有少量的FeCl2杂质。现要测定其中铁元素的质量分数,按以下步骤进行实验:
请根据图的流程,回答下列问题:
⑴操作I的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有????????(填仪器名称);操作II必须用到的仪器是????????????。(填字母)
A.50ml烧杯
B.50ml量筒
C.100ml量筒
D.25ml滴定管
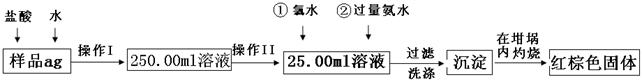
⑵再加入氨水的离子方程式为???????????????????????????????。
⑶检验沉淀是否洗涤干净的操作是
????????????????????????????????????????????????????????????????。
⑷将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,则接下来还应进行的操作是?????????????。
⑸若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数是????????????????????。
⑹有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干燃烧称量即可,请你评价是否可行?????????。(填“可行”或“不可行”)
5、选择题 用黄色的FeCl3溶液分别进行下列实验,解释或结论不正确的是?? ( )。
选项
| 实验
| 现象
| 解释或结论
| A
| 加入FeCl3固体
| 溶液变成红褐色
| FeCl3的水解程度变大
| B
| 加入等体积水
| 溶液颜色变浅
| c(Fe3+)变小
| C
| 加入足量Fe粉
| 溶液颜色变成浅绿色
| 2Fe3++Fe=3Fe2+
| D
| 将FeCl3溶液微热
| 溶液变成红褐色
| 水解反应ΔH>0
?
|
|