微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。
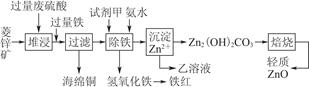
请结合下表数据,回答问题:
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 6.3
| 9.7
|
Fe3+
| 1.5
| 3.2
|
Zn2+
| 6.2
| 8.0
?
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 ?????B.Cl2 ??????C.H2O2 ?????D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn ????b.ZnO ???c.Zn(OH)2 ?? d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17? mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。
2、填空题 (6分)铁及其化合物之间的相互转化可用下式表示:

回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是???????????(选填序号);
a.Cl2??? b.Fe???? c.HNO3???? d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S(CuFeS2中S为-2价)。
则下列说法正确的是????????????(选填序号);
a.从物质的组成来看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol e-?时,有46 g CuFeS2参加反应
(3)高铁酸钾是一种新型、高效的绿色净水剂,其净水原理是?????????????????????????。
3、选择题 在硫酸铁溶液中,加入a g 铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是????????????????????
A.最后得到的溶液中不含有Cu2+
B.残余固体一定全部是铜
C.最后得到的溶液中只含Cu2+
D.残余固体可能为铁、铜混合物
4、简答题 某同学利用铁与水蒸气反应后的固体物质进行了如下实验:

(1)固体溶于稀盐酸的化学方程式为______.
(2)试剂1的化学式是______.
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示):______.
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究.
①提出假设:
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:______;
②设计方案:
为了对你所提出的假设2进行验证,你设计的实验方案是______.
5、选择题 甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系。 下列说法正确的是 下列说法正确的是
A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
B.若甲为金属单质,乙为非金属单质,则甲只能是Mg
C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
|