微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 科研、生产中常涉及铁及其化合物
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:________________。
参考答案:(1)稀硫酸和铁粉
(2)杀菌剂(强氧化剂)和吸附剂(
本题解析:(1)FeSO4是强酸弱碱盐,易发生水解使溶液呈酸性,配制溶液时,需加入稀硫酸抑制Fe2+水解,FeSO4具有较强的还原性,还需加入铁粉,防止Fe2+被氧化。
(2)高铁酸钾中铁为+6价,具有很强的氧化性,可用于杀菌,高铁酸钾的还原产物是Fe3+,易水解生成氢氧化铁胶体,具有较强的吸附杂质的能力,可用于净水。
(3)该电池放电时,Zn失电子,为电池的负极,结合产物Zn(OH)2,可写出放电时的负极反应式为Zn+2OH--2e-=Zn(OH)2,正极反应式为FeO42-+4H2O+3e-=Fe(
本题难度:困难
2、实验题 (14分)Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设
假设1:红色粉末只含Fe2O3;
假设2:_______________________________;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究
取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解(温馨提示:Cu+2Fe3+=Cu2++2Fe2+)。上述三个假设中,可能成立的是____________________。
(3)进一步探究
完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L—1 H2SO4、3 mol·L—1 NaOH、0.01 mol·L—1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液。
实验步骤
| 预期现象和结论
|
?
| ?
|
?
| ?
参考答案:(14分)(1)红色粉末只含Cu2O (4分)???
本题解析:略
本题难度:一般
3、选择题 把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。
最先观察到酚酞变红的现象的区域是

A.I和III
B.I和IV
C.II和III
D.II和IV
参考答案:B
本题解析:
正确答案:B
左边原电池,I作正极:2H2O+2e-=H2+2OH―,碱性增强;右边电解池, IV作阴极:2H2O+2e-=H2+2OH―,碱性增强
本题难度:简单
4、填空题 试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.
 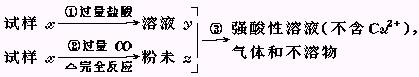
 (1)请写出步骤③中所发生的全部反应的离子方程式. (1)请写出步骤③中所发生的全部反应的离子方程式.
 (2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为???????????(用m表示). (2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为???????????(用m表示).
参考答案:(1)Fe+Cu2+=Fe2++Cu? Fe+2H+=Fe2
本题解析: 本题第一问比较简单.发生的反应为:Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2↑ 本题第一问比较简单.发生的反应为:Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2↑
 第二问是考 第二问是考
本题难度:一般
5、选择题 下列关于实验现象的描述不正确的是????????(???)
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.葡萄糖与新制的氢氧化铜悬浊液混合,加热,有红色沉淀生成
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
参考答案:C
本题解析:略
本题难度:一般
|