微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用足量的CO还原32.0g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60g沉淀,则该氧化物是
A.FeO
B.Fe2O3
C.CuO
D.Cu2O
参考答案:B
本题解析:
解:由关系式C0 ~CaCO3得,n(CaCO3)=60g/100g·mol-1=0.6mol=n(CO)
0.6molCO能还原A、72g/mol×0.6mol=43.2g;B、160 g/mol×0.6mol/3=32.0g符合题意;C、80 g/mol×0.6mol=48.0g;D、144 g/mol×0.6mol=86.4g
综上所述,正确答案为D
本题难度:一般
2、填空题 实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是??????????????;配制完毕后要加入少量铁屑,其目的是?????????????????????????????????。
参考答案: 本题解析:略
本题解析:略
本题难度:一般
3、选择题 物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是
A.常温下,“纳米铜”比铜片的金属性强
B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”与铜片的还原性相同
D.常温下,“纳米铜”比铜片的氧化性强
参考答案:C
本题解析:略
本题难度:一般
4、选择题 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.V=224
C.样品中CuO的质量为4.0g
D.V=448
参考答案:D
本题解析:
试题分析:推断一:滤渣3.2g一定是全部的铜(硫酸足量可以说明沉淀中无Fe、CuO、Fe2O3,溶液无铜离子可以说明铜都析出了);固体为铜说明溶液中中没有Fe3+(它要和铜反应),所以A错。推断二:最后灼烧得到固体3.2g为Fe2O3,其中含铁元素质量为3.2×112/160=2.24g。铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,所以C错。推断三:由于最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量=2.24/56=0.04mo
本题难度:一般
5、填空题 某合金中铜和铁的物质的量均为0.3mol,将其全部投入b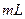 4
4  的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
(1)若金属有剩余,其质量为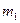 g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为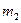 g,则
g,则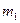 与
与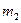 的关系为:
的关系为: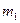 ?????
?????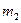 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)若b=450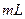 ,则溶液中的金属阳离子为????????????????。
,则溶液中的金属阳离子为????????????????。
(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程)
参考答案:(1)>(2分)
(2)  本题解析:略
本题解析:略
本题难度:简单