微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】
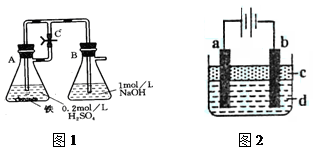
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:???????????????????????????????????????。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:①纯水?②NaCl溶液?③NaOH溶液?④四氯化碳?⑤CuCl2溶液?⑥乙醇?⑦Fe棒?⑧植物油?⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
【探究思考】
实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
资料名称
| 物理性质描述
| 化学性质描述
|
《化学辞典》,顾翼东编,1989年版P637
| 白色无定形粉末或白色至淡绿色六方晶体
| 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花
|
《大学普通化学(下册)》 傅鹰著P637
| 白色沉淀
| 此沉淀易被氧化成微绿色Fe3(OH)8
|
《普通化学教程》(下册)P788
| 白色
| 能强烈吸收O2,迅速变成棕色
Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。
?
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________????;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
2、选择题 某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42- 的物质的量浓度为6 mol·L-1,则此溶液最多溶解铁粉的质量为(??)
A.5.6 g
B.11.2 g
C.22.4 g
D.33.6 g
3、填空题 (14分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有?????????????。
(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)?????????????????。
在实验室中,常将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示)。
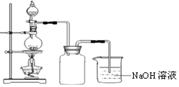
(3)写出烧瓶中发生反应的离子方程式为????????????????????????????????
(4)广口瓶的作用是?????????????????
(5)为符合绿色化学的要求,某研究性学习小组进行如下
设计:将3.2 g铜丝放到45 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入18 mL 10%的H2O2,反应0.5h后,升温到60 ℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5 g。请回答:
①加热时温度不宜过高的原因是???????????????????????????;
②本实验CuSO4·5H2O的产率为??????????????。
4、选择题 完全溶解28.4 g碳酸铜和氢氧化铜的混合物需要消耗1 mol·L-1的盐酸500 mL。若灼烧相同质量的上述混合物,能得到氧化铜的质量为
A.40 g
B.30 g
C.20 g
D.16 g
5、选择题 关于铁的叙述正确的是(???)
①铁能被磁体吸引,纯铁易生锈?②在人体的血红蛋白中含有铁元素?③铁位于元素周期表
中第4周期第ⅧB族?④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧?⑤铁与强氧化剂
硝酸反应的产物一定是Fe(NO3)3?⑥不能通过化合反应制得FeCl2和Fe(OH)3
A.①③
B.②④
C.②⑤
D.④⑥
|