微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用水热法制备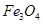 纳米颗粒的总反应如下:
纳米颗粒的总反应如下:
3 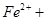 ?
?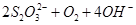 ===
===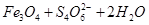 。下列说法正确的是
。下列说法正确的是
A.在反应中硫元素被氧化,铁元素被还原
B.还原剂是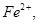 氧化剂是
氧化剂是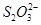 和
和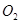
C.每生成1 mol 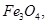 转移3 mol电子
转移3 mol电子
D.当转移1 mol电子时,消耗56 g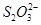
参考答案:D
本题解析:根据方程式可知,铁元素的化合价从+2价部分升高到+3价,失去电子,被氧化,A不正确;硫元素的化合价从+2价升高到+2.5价,失去电子被氧化,作还原剂,B不正确;氧气中氧元素的化合价从0价降低到-2价,得到电子,被还原,作氧化剂,反应中转移4个电子,所以C不正确,D正确,答案选D。
本题难度:一般
2、填空题 (16分)某同学为了验证Fe3+是否能氧化H2SO3生成了SO42
参考答案:
本题解析:
本题难度:困难
3、计算题 15.8gKMnO4与100mL12mol/L过量浓盐酸充分反应,化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl+5Cl2↑+8H2O,通过计算回答:
(1)产生的Cl2在标准状况下的体积为多少?
(2)有多少摩尔HCl被氧化?
(3)在反应后的溶液中加足量的AgNO3溶液可生成多少克沉淀?
参考答案:(1)5.6L (2分)??????(2)0.5mol(3分
本题解析:
试题分析:(1)15.8g高锰酸钾的物质的量=15.8g÷158g/mol=0.1mol
浓盐酸的我知道=0.1L×12mol/L=1.2mol
根据方程式可知
2KMnO4+16HCl=2KCl+2MnCl+5Cl2↑+8H2O
2mol???? 16mol????????????? 5mol
0.1mol?? 0.8mol????????????? 0.25mol
这说明反应中浓盐酸是过量的,因此生成的氯气在标准状况下的体积=0.25mol×22.4L/mo
本题难度:一般
4、填空题 (4分)过量铁粉与稀硝酸反应的方程式为:
Fe+HNO3(稀)→Fe(NO3)2+NO↑+H2O
(1)请写出上述反应配平的离子方程式 ;
(2)标准状况下,当生成2.24L NO气体时,转移电子的物质的量为 ,有 mol氧化剂被还原。
参考答案:
(1)3Fe+8H++2NO3- &
本题解析:略
本题难度:简单
5、选择题 用CH4催化还原 NOx可以消除氮氧化物的污染。例如:
① CH4 ( g ) + 4NO2 ( g ) =" 4NO" ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一574kJ·mol-1?②CH4 ( g ) + 4NO ( g ) = 2N2 ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一1160kJ·mol一1下列说法不正确的是
A.由反应①可推知:CH4 ( g ) + 4NO2 ( g ) =" 4NO" ( g ) + CO2 ( g ) + 2H2O ( l) ;
△H>一574 kJ·mol-1
B.反应①②转移的电子数相同
C.若用标准状况下 4.48LCH4还原 NO2至 N2,放出的热量为 173.4kJ。
D.若用标准状况下 4.48LCH4还原 NO2至 N2,整个过程中转移的电子总数为1.60 mol
参考答案:A
本题解析:A与①比较生成水的状态不同,生成液态水放出的热量多,所以△H<一574kJ·mol-1 ;由电子转移可知反应①和②转移的电子数相同。CH4还原 NO2至 N2,可得方程式为:
CH4(g) + 2NO 2 (g)="=" N2 (g) + CO2 (g) + 2H2O(g);△H=-867kJ·mol-1,所以4.48LCH4转移电子数为1.60mol,放出的热量为173.4kJ。
本题难度:一般