微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NH3具有一定的还原性,常温下可被Cl2氧化为N2。在一密闭容器中,充入一定量NH3和Cl2充分反应后,恢复到原状态所得气体产物体积最小,则反应前Cl2和NH3的体积比是
A.3:2
B.3:5
C.3:8
D.无法计算
参考答案:C
本题解析:
试题分析:NH3具有一定的还原性,常温下可被Cl2氧化为N2,而氯气的还原产物是氯化氢。氯化氢能和氨气反应生成固体氯化铵,所以充分反应后,恢复到原状态所得气体产物体积最小,则生成物应该是氨气和氯化氢,即反应的化学方程式是8NH3+3Cl2=6NH4Cl+N2,答案选C。
点评:该题设计新颖,贴近高考,注重答题的灵活性,有利于培养学生的逻辑思维能力和发散思维能力。该题的关键是明确气体的物质的量越小,容器内的压强越小,然后结合题意灵活运用即可。
本题难度:一般
2、选择题 在热的稀硫酸溶液中溶解了45.6gFeSO4。当加入200mL0.5mol?L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是
A.N2O
B.NO
C.N2O3
D.NO2
参考答案:B
本题解析:
试题分析:硫酸亚铁的物质的量是0.3mol,失去0.3mol电子。硝酸钾的物质的量是0.1mol,所以根据电子的得失守恒可知,硝酸钾中氮元素应该得到3个电子,所以化合价从+5价降低到+2价,答案选B。
点评:该题是高考中的常见题型和重要的考点之一,试题基础性强,属于中等难度的试题。该题的关键是利用好电子的得失守恒,有利于培养学生的逻辑推理能力和应试能力,提升学生的学科素养。
本题难度:简单
3、选择题 浓盐酸和氯酸钾的反应如下:KClO3 + 6HCl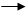 KCl + 3Cl2 ↑?+ 3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是
KCl + 3Cl2 ↑?+ 3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是
A.1∶6
B.1∶5
C.5∶1
D.6∶1
参考答案:C
本题解析:
试题分析:根据方程式可知,氯酸钾中氯元素的化合价从+5价降低到0价,得到5个电子,被还原,发生还原反应。氯化钾中氯元素的化合价从-1价升高到0价,失去1个电子,被氧化,发生氧化反应,则根据电子的得失守恒可知,发生氧化反应的氯原子和发生还原反应的氯原子的质量比是5∶1,答案选C。
点评:该题是中等难度的试题的考查,也是高考中的常见考点。试题基础性强,旨在巩固基础,提高学生的应试能力。该题的关键是准确判断出有关元素的化合价变化情况,然后依据有关的概念并结合电子得失守恒进行判断和计算即可,有利于培
本题难度:一般
4、选择题 4 mL 0.5 mol/L的某KXO4溶液恰好能将160 mL 0.1 mol/L的FeSO4的酸性溶液反应完全,则X元素在还原产物中的化合价为
A.-1
B.0
C.+2
D.+3
参考答案:A
本题解析:
试题分析:已知XO4-中X的化合价是+7价,反应中XO4-与Fe2+的物质的量之比是1:8,8molFe2+氧化成Fe3+,转移8mole-, 则1mol XO4-转移8mole-,X元素在还原产物中的化合价为-1。答案A正确
本题难度:一般
5、填空题 已知 2Na2O2+2CO2=2Na2CO3+O2,因此Na2O2可在呼吸面具和潜水艇里作供氧剂。
(1)请在答卷上用双线桥法标出上述方程式的电子转移方向和数目。
(2) ???????是还原剂,???????是还原产物。
(3)若转移3mol电子,则所产生的氧气在标准状况下的体积为???????。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)过氧化钠与二氧化碳的反应中,过氧化钠既是氧化剂又是还原剂,
(2)过氧化钠既是氧化剂又是还原剂,还原产物是氧化剂发生还原反应后的产物,为Na2CO3
(3)每生成1mol的氧气,则转移2mol电子,当转移3mol电子时会有1.5mol的氧气生成,标准状况下的体积为33.6L
本题难度:一般