微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 矿物胆矾就是CuSO4·5H2O,当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积下来;而反应得到的铁和硫则进入水溶液,该溶液无臭味,透明不浑浊,绿色,呈强酸性,在有的矿区常可见到这种具有强腐蚀性的地下水(俗称黑水)渗出地面,上述反应可以用一个化学方程式来表示,试写出配平的化学方程式。
2、填空题 铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g)?△H=-768.2kJ·mol-1,①
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g)???△H=+116.0kJ·mol-1,②
①热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4?。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)="1" mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
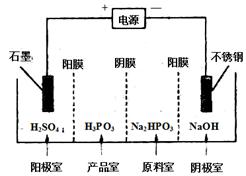
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
3、填空题 (12分)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢。K2Cr2O7和CrO3大量用于鞣革、印染、颜料、电镀等工业中,是工业上造成铬污染的主要原因。近期暴光的“毒胶囊”事件中,就是因为用工业皮革的下脚料或破皮鞋等为原料制成的工业明胶被冒充成食用明胶制成胶囊,造成胶囊内的铬严重超标。
(1)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。?
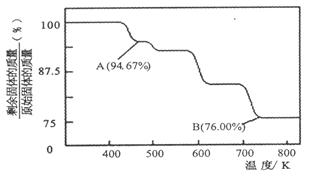
①A 点时剩余固体的成分是???????(填化学式)。
②从开始加热到 750K 时总反应方程式为?????????????????????????????。
(2)Cr(Ⅵ)主要以CrO42-和Cr2O72-形态存在,在酸性条件下具有很强的氧化性,它们在溶液中存在如下转化:CrO42-(黄色)+2H+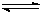 ?Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是?????????????。
?Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是?????????????。
A.加NaOH
B.加盐酸
C.加硫酸
D.加AgNO3
(3)工业废水中常含有一定量的Cr(Ⅵ),毒性较大,它们会对人类及生态系统产生很大损害。净化处理方法之一是将含Cr2O72-的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀以除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是???????????????????????????????。
②写出阳极的电极反应式???????????????????????????????????。?
③写出Fe2+和Cr2O72-发生反应生成Fe3+和Cr3+的离子反应方程式??????????????????。
④已知电解后的溶液中c(Fe3+)=2.0×10-13 mol·L-1,则溶液中c(Cr3+)为??mol·L-1。
4、选择题 有时候,将氧化还原反应方程式拆开写成两个“半反应”。下面是一个“半反应”式:MnO+____H++____e-——____Mn2++____H2O
该反应方程式的配平化学计量数是( )
A.1,8,4,1,4
B.2,16,5,2,8
C.1,6,5,1,3
D.1 ,8,5,1,4
,8,5,1,4
5、选择题 对反应14CuSO4+5FeS2+12H?2O=7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
A.该反应的氧化剂只有CuSO4
B.SO42-既不是氧化产物也不是还原产物
C.1 mol CuSO4还原了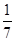 mol的S
mol的S
D.被还原的S和被氧化的S的质量比为7:3