微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分)
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式。 正极 ,负极 ,电解质溶液 ,电极反应式 、 。
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A 称量的是长期暴露在空气中的NaOH
B 容量瓶不干燥
C 将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制。
D 混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切
参考答案:(1)正极:C或Cu;负极:Zn ;电解质溶液:FeCl3溶
本题解析:
试题分析:(1)由反应Zn+2FeCl3
本题难度:一般
2、填空题 (12分)(1)已知N≡N、N—H、H—H的键能分别为946kJ·mol-1、390.8kJ·mol-1、436.0kJ·mol-1。试根据盖斯定律,写出合成氨反应的热化学方程式 。
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式____________。
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做 极,电极反应式为 ;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________,该电池总反应的离子方程式为_____________。
参考答案:(12分)
(1)N2(g)+3H2(g)![]()
本题解析:
试题分析:(1)化学反应的实质是破坏化学键吸收能量和形成化学键释放能量的过程,根据化学反应N2(g)+3H2(g) 2NH3,破坏化学键吸收的能量为946kJ·mol-1+3×436.0kJ·mol-1="2254" kJ·mol-1,形成化学键释放的能量为390.8kJ·mol-1×6=2344.8kJ·mol-1,则热量变化为2254 kJ·mol-1-2344.8kJ·mol-1=-90.8kJ/mol,合成氨反应的热化学方程式为N2(g)+3H2(g)
2NH3,破坏化学键吸收的能量为946kJ·mol-1+3×436.0kJ·mol-1="2254" kJ·mol-1,形成化学键释放的能量为390.8kJ·mol-1×6=2344.8kJ·mol-1,则热量变化为2254 kJ·mol-1-2344.8kJ·mol-1=-90.8kJ/mol,合成氨反应的热化学方程式为N2(g)+3H2(g) 2NH3 (g) △H =-90.8kJ/mol。
2NH3 (g) △H =-90.8kJ/mol。
(2)中和热是指强酸强碱的稀溶液反应生成1mol水时放出的热量,1mol的稀硫酸完全反应时放出akJ的热量,则生成1mol水时放出的热量为a/2,该反应中和热的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+ H2O(l) △H=-a/2kJ/mol。
(3)镁和铝为电极,以NaOH作电解质溶液构成的原电池,铝与氢氧化钠反应,而镁不反应,所以,铝作负极,电极反应式为Al-3e+4OH-=2H2O+AlO2-;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,则FeO42-得电子生成Fe(OH)3和OH-,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,负值是Zn失电子,在碱性溶液中生成Zn(OH)2,电极反应为Zn-2e-+2OH-=Zn(OH)2,再根据正负极转移电子数相等,配平,然后正负极相加得该电池总反应,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)。
考点:考查盖斯定律的应用,中和热及原电池电极反应的书写。
本题难度:一般
3、填空题 市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
(1)“热敷袋”放出的热量是利用铁发生了 反应放出热量。
(2)炭粉的主要作用是 。
(3)加入氯化钠的主要作用是 。
(4)木屑的作用是 。
参考答案:(1)氧化
(2)作为导电的固体物质,让铁成为原电池的
本题解析:由铁屑能在氧气中燃烧同时迅速放出大量的热,可推知铁在潮湿的情况下生锈时也会放出热量,只是比燃烧缓慢一些。日常生活中铁生锈过于缓慢,热量的释放也非常缓慢,难以觉察到。倘若提供适当的条件(如较浓的电解质溶液、导电且不活泼的固体物质)让铁成为原电池的负极材料,铁的氧化速率就会增大。木屑作用是让“热敷袋”产生的热量均匀地向外散失、传递。
本题难度:一般
4、选择题 原电池产生电流的本质原因是
A.原电池中溶液能电离出自由移动的离子]
B.有两根导线将两个活泼性不同的电极连接
C.电极上自发进行的氧化还原反应中有电子的转移
D.电极上进行的氧化还原反应的生成物为电子
参考答案:C
本题解析:原电池产生电流的本质原因是电极上自发进行的氧化还原反应中有电子的转移
本题难度:一般
5、选择题 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。
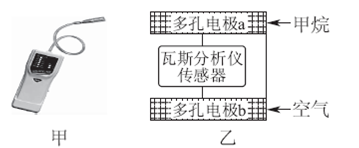
下列有关叙述正确的的是( )
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为:CH4+4O2--8e-===CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
参考答案:C
本题解析:
试题分析:电子不能在电池内电路流动,只能在外电路中流动,A错;燃料电池中,通入燃料的一极为负极,阳离子移向正极,阴离子移向负极,B错;甲烷在负极发生失电子氧化反应,电极反应为:CH4+4O2--8e-===CO2+2H2O,C正确;1 mol O2得4 mol电子生成2 mol O2-,故当固体电解质中有1 mol O2-通过时,电子转移2 mol,D错。
本题难度:一般