微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (9分)将铜片、锌片和250mL稀硫酸组成原电池,当在铜片上放出6.72L(标准状况下)的气体时,H2S04恰好反应完全。
(1)该原电池的负极反应式为
(2)原稀硫 酸的物质的量浓度是 mol·L-1
酸的物质的量浓度是 mol·L-1
(3)列式计算锌片减少 的质量。
的质量。
参考答案:(1) 本题解析:略
本题解析:略
本题难度:一般
2、填空题 (10分)为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。

(1)甲装置中,a电极的反应式为________________________________________。
(2)乙装置中,阴极区产物为_________________________。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_______(填“正”或“负”)极,该装置内发生反应的化学方程式为________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为____________(不考虑气体的溶解)。
参考答案:(1)H2+2OH--2e-=2H2O (2)Na
本题解析:
试题分析:(1)甲装置中,a电极通入的是氢气,因此a电极是负极,发生氧化反应。由于电解质溶液显碱性,则电极反应式为H2+2OH--2e-=2H2O;
(2)乙装置是电解饱和食盐水,阴极是溶液中的氢离子放电,产生氢气。同时破坏水中的电离平衡,从而产生氢氧根离子,钠离子向阴极运动,所以阴极区产物为NaOH和H2;
(3)丙装置中与电源a电极相连的电极上连有导管口,这说明该电极生成的氢气,因此a是电源的负极。阳极是溶液中的氯离子放电生成氯气,产生的氯气与另外一种生成物氢氧化钠反应生成次氯酸钠,从而制得消毒液,该反应的化学方程式为NaCl+H2O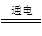 NaClO+H2↑。
NaClO+H2↑。
(4)若甲装置作为乙装置的电源,因此满足电子转移守恒。每消耗2mol氢气同时消耗1mol氧气,转移4mol电子。而在乙装置中可以产生2mol氢气和2mol氯气,所以一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为3:4。
考点:考查电化学原理的应用
本题难度:一般
3、填空题 (共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) CO(g)
CO(g) CH3OH(g)
CH3OH(g) 90.8 kJ
90.8 kJ
② 2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)
H2O(g) 23.5 kJ
23.5 kJ
③ CO(g) H2O(g)
H2O(g) CO2(g)
CO2(g) H2(g)
H2(g) 41.3 kJ
41.3 kJ
总反应:3H2(g) 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,其中Q
Q,其中Q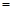 kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压??????????????? b.加入催化剂??????????? c.减少CO2的浓度???? d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
物质
| CH3OH
| CH3OCH3
| H2O
|
浓度/(mol·L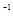 ) )
| 0.44
| 0.6
| 0.6
比较此时正、逆反应速率数值(单位相同)的大小: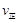 (甲醇) (甲醇) 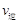 (水)(填“>”、“<”或“=”)。 (水)(填“>”、“<”或“=”)。
反应开始时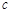 (CH3OH) (CH3OH)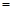 ? ; ? ;
该时间内的平均反应速率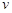 (CH3OH) (CH3OH)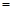 ; ;
该温度下反应的平衡常数值为 。(精确到0.01)
参考答案:(1).C +H2O 本题解析:(1)碳在高温下和水蒸气反应,即生成水煤气,反应式为C +H2O 本题解析:(1)碳在高温下和水蒸气反应,即生成水煤气,反应式为C +H2O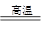 CO +H2 。 CO +H2 。
(2)两种酸式盐分别是NaHS和 NaHCO3,所以方程式为H2S+Na2CO3 →NaHS + NaHCO3。
(3).根据盖斯定律可知,①×2+②+③即得到3H2(g) 本题难度:一般 本题难度:一般
4、选择题 某些食品包装盒中有一个小袋,袋上注明“双吸剂,不可食用”,通过上网查询得知其主要成分是铁粉、活性炭和氯化钠”。关于这种双吸剂的分析判断错误的是
A.具有抗氧化作用
B.可吸收食品盒内的O2和N2
C.发挥作用时利用了原电池原理
D.变为红褐色后失效
参考答案:B
本题解析:
试题分析:是指在空气中即能吸收氧气也能吸收水分的物质,可用铁吸收空气中的氧气与水蒸气,具有抗氧化作用,故A正确;双吸剂能够吸收空气中的O2和水蒸气,但无法吸收空气中的N2,故B错误;双吸剂发挥作用时利用了原电池反应,正极(C):2H2O+O2+4e-=4OH- 负极(Fe):Fe-2e-=Fe2+,故C正确;当铁被氧化为红褐色Fe(OH)3不能在继续与空气中氧气反应,即失效,故D正确。
本题难度:一般
5、选择题 控制合适的条件,将反应
设计成如图所示的原电池。下列判断不正确的是(???)
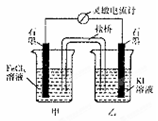
A.反应开始时,乙中石墨电极上发生的电极反应式为2I——2e—===I2
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中加入FeCl2固体,乙中石墨电极为负极
参考答案:D
本题解析:本题可将总反应拆开;为2Fe3++2e-=2Fe2+,还原反应做正极;2I——2e—=I2,氧化反应,正极。故乙为正极,D错误。
本题难度:一般
|