微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知BF3分子的空间构型为平面三角形,用等电子原理判断,下列分子或离子的立体构型不是平面三角形的是[???? ]
A.SO3
B.PCl3
C.NO3-
D.BCl3
参考答案:B
本题解析:
本题难度:简单
2、选择题 某物质的晶体中含Ti、O、Ca三种元素,其晶胞排列方式如右图所示,晶体中Ti、O、Ca的个数之比为(???)?
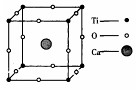
A.1∶3∶3
B.2∶3∶1
C.2∶2∶1
D.1∶3∶1
参考答案:D
本题解析:略
本题难度:简单
3、选择题 石墨晶体如图所示,每一层由无数个正六边形构成,则平均每个正六边形成占有的碳原子数

A.6个
B.4个
C.3个
D.2个
参考答案:D
本题解析:由每个碳原子即图中的顶点,均分属三个面共有,故分归到每个面均为1/3,而每个正六边形均有6个点,所以平均每个正六边形所占有的碳原子数为6×1/3=2(个)
本题难度:一般
4、选择题 钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的结构示意图为下图,它的化学式是
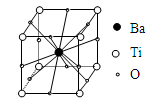
A.BaTi8O12
B.BaTi4O6
C.BaTi2O4
D.BaTiO3
参考答案:D
本题解析:Ba在体心上,1个;
Ti在8个顶点上,则8×(1/8)=1;
O在每条边的中点上,则12×(1/4)=3;
本题难度:简单
5、选择题 下列各组物质的熔沸点按由低到高的顺序排列正确的是
A.冰、干冰、氯化钠、金刚石
B.汞、钠、烧碱、二氧化硅
C.NaCl、KCl、CsCl
D.H2O、H2S、H2Se、H2Te
参考答案:B
本题解析:
试题分析:A.熔沸点按由低到高的顺序排列应该是干冰冰、、氯化钠、金刚石 。错误。B.汞、钠、烧碱、二氧化硅正确。C.NaCl、KCl、CsCl都是离子晶体。离子所带的电荷相同。离子半径越大,离子间的作用力就越小,熔点就越低。因此熔沸点按由低到高的顺序排列CsCl、KCl、NaCl。错误。D.H2O、H2S、H2Se、H2Te 它们都是结构相似的物质。除水外,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高。而水的分子之间还存在着氢键,增加了分子之间的相互作用力,使其熔沸点最高。因此物质的熔
本题难度:一般