微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
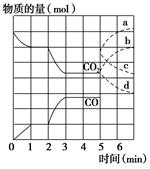
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=________。
(2)反应进行至2 min时,若只改变温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH________0(填“>”、“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是________(填写编号)。
a.v正先增大后减小? b.v正先减小后增大
c.v逆先增大后减小? d.v逆先减小后增大
表示n(CO2)变化的曲线是________(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:_____________。
参考答案:(1)0.1 mol·L-1·min-1
(2)>
本题解析:(1)Fe→FeO,固体质量增加3.2 g,说明生成FeO 0.2 mol,v(CO2)=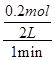 =0.1 mol·L-1·min-1。(2)由于建立新平衡的反应速率加快,可知升高温度,平衡正向移动,说明正反应吸热。(3)充入CO,CO浓度增大,逆反应速率增大,之后逐渐减小;5 min时CO2浓度不变,正反应速率不变,
=0.1 mol·L-1·min-1。(2)由于建立新平衡的反应速率加快,可知升高温度,平衡正向移动,说明正反应吸热。(3)充入CO,CO浓度增大,逆反应速率增大,之后逐渐减小;5 min时CO2浓度不变,正反应速率不变,
本题难度:一般
2、填空题 请回答下列化工生产中的一些问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填标号)。
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(3)为提高SO3吸收率,实际生产中通常用 吸收SO3。
(4)已知反应2SO2(g)+O2(g)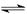 2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃
| 600
| 620
| 640
|
炉渣中CuSO4的质量数/%
| 9.3
| 9.2
| 9.0
已知CuSO4在低于660 ℃时不会分解,请简要分析上表中CuSO4 的质量分数随温度升高而降低的原因 。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用 (填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式 。
参考答案:(1)C
(2)4CuFeS2+13O2![]()
本题解析:(1)硫酸具有很强的腐蚀性,运输成本较高,故硫酸厂厂址应靠近硫酸消费中心;(2)由题意可知,反应物为CuFeS2和O2,产物为CuO、Fe2O3和SO2,配平即可;(3)SO3与水反应放出大量的热,易形成酸雾,影响SO3的吸收,故用水吸收的效率很低,而用98%的浓硫酸则可避免酸雾的形成,达到较高的吸收率;(4)设平衡时反应的O2的物质的量为x,可得反应的三段式:
2SO2 + O2
本题难度:困难
3、选择题 已知反应:2CH3COCH3(l) CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是 CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
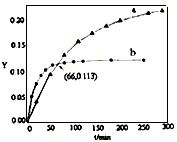 [???? ] [???? ]
A.b代表0℃下CH3COCH3的Y-t 曲线
B.反应进行到20min末,CH3COCH3的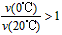
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的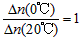
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列叙述中能肯定判断化学平衡发生了移动的是( )
A.体系中气体的密度发生变化
B.体系中各组分的物质的量浓度发生变化
C.体系中各组分的体积分数发生变化
D.正反应和逆反应速率均发生变化
参考答案:A、对于反应前后气体体积相等的反应来说,增大压强,气体的密度
本题解析:
本题难度:一般
5、填空题 (8分)在 1.0L恒容密闭容器中放入0.10 mol A (g),在一定温度进行如下反应。
A(g) 2B(g) + C(g) + D(s) △H =" +" 85.1 kJ / mol 2B(g) + C(g) + D(s) △H =" +" 85.1 kJ / mol
容器内气体总压强(P)与起始压强P。的比值随反应时间(t)变化数据见下表(提示:密闭容器中的压强比等于气体物质的量之比)。

回答下列问题:
(1)下列能提高 A 的转化率的是 。
A.升高温度 B.向体系中通人A气体
C.减少D的物质的量 D.向体系中通人稀有气体He
(2)平衡时A的转化率为 (保留两位有效数字)。
(3)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则 D 的取值范围 n (D) mol 。
(4)将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时 B 的浓度为
参考答案:(1)A;(2)70%;(3)>0.03;(4)0.0
本题解析:
试题分析:(1)A.该反应的正反应是吸热反应,升高温度,根据平衡移动原理,化学平衡向吸热反应方向移动,对该反应来说向正反应方向移动,所以能提高 A 的转化率,正确;B.向体系中通人A气体 ,平衡正向移动,但是平衡移动消耗量远小于投入量,所以A的转化率反而降低,错误;C.由于D是固体,所以减少D的物质的量,平衡不发生移动,A的转化率不变,错误; D.向体系中通人稀有气体He,平衡不发生移动,所以A的转化率不变,错误;(2)在恒容的密闭容器内进行的反应,容器内气体的压强之比等于气体的物质的量的比。假设A转化物质的量为x,则平衡时各种气体的物质的量分别是:A:(0.1-x)mol;B:0.2xmol;C:xmol。根据表格提供的数据可知:[(0.1-x)+0.2x+0.1x]÷0.1=2.40,解得x=0.07mol,所以平衡时A的转化率为(0.07mol÷0.1mol)×100%=70%;(3)根据反应方程式可知:若相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则 在平衡时含有A的物质的量为0.03mol,每产生1mol的A,就消耗1mol的D,所以D 的取值范围 n (D) >0.03mol。(4)在恒压条件下,气体的体积比等于气体的物质的量的比。将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时A 的转化率仍然为70%;则B的物质的量为0.1mol×0.7×2=0.14mol,平衡时各种气体的总物质的量为: 0.1mol×0.3+0.14mol+0.1mol×0.7=0.24mol;平衡时容器的容积是(0.24mol×1L)÷0.1mol=2.4L,所以B的物质的量浓度是c(B)= 0.14mol÷2.4L=0.0583mol/L。
考点:考查影响化学平衡移动的因素、物质的转化率、等效平衡、物质的平衡浓度的计算的知识。
本题难度:困难
|