微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某些高档点心的包装盒内有个小纸袋,小纸袋内装有灰黑色粉末,其中有些已变成棕褐色,将灰黑色粉末溶于盐酸,取上层清液滴入几滴氯水,在滴入KSCN溶液,马上出现血红色,以下结论不正确的是
A.该灰黑色粉末用做抗氧化剂
B.小纸袋内可能装有活性铁粉
C.小纸袋内的原装粉末可能是Fe2O3
D.该灰黑色粉末不可食用
参考答案:C
本题解析:
答案:C
C.不正确,小纸袋内的原装粉末可能是还原性Fe粉,不可食用,作抗氧剂。
本题难度:一般
2、选择题 把足量的铁粉投入到溶解有硫酸和硫酸铜的溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为
A.1:4
B.2:7
C.1:2
D.3:8
参考答案:A
本题解析:掌握“差量法”的运用
铁粉发生的反应为(设硫酸铜、硫酸分别为xmol、ymol):
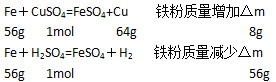
依题意可知:8x=56y,即x:y=7:1
则可计算出原溶液中H+与SO42-的物质的量浓度之比为:2×1:(7+1)=1:4
答案为A
本题难度:一般
3、填空题 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
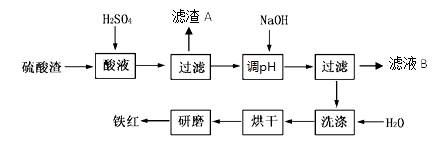
(1)硫酸渣的成分中属于两性氧化物的是???????,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式????????????????;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是???????????(部分阳离子以氢氧化物形式沉淀时溶液 的pH见下表)
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
|
开始沉淀
| 2.7
| 3.8
| 7.5
| 9.4
|
完全沉淀
| 3.2
| 5.2
| 9.7
| 12.4
?
(3)滤渣A的主要成分为??????,滤液B可以回收的物质有____________;
(4)简述洗涤过程的实验操作????????????????????????????????????;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为????????(用最简分数表达式表示)。
参考答案:(1)Al2O3????? Fe2O3 + 6H+ ==2F
本题解析:(1)Al2O3为两性氧化物,硫酸渣的成分中属于两性氧化物的是Al2O3;Fe2O3与硫酸反应生成Fe2(SO4)3和H2O,离子方程式是Fe2O3+6H+=2Fe3++3H2O;
(2)由题所给的数据可以看出,要使Fe3+完全沉淀而其它离子不能沉淀,其pH范围是3.2-3.8;
(3)硫酸渣中SiO2不与硫酸反应,所以滤渣A的主要成分是SiO2;加入NaOH调节pH后,Fe3+转化为Fe(OH)3沉淀,其它离子仍为硫酸盐,所以滤液B可以回收的物质有:Na2SO4、Al2(SO4)3、MgSO
本题难度:一般
4、实验题 (10分)实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参与反应)。请回答下列问题:
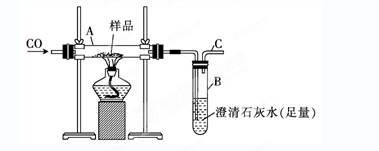
(1)该实验中炼铁的方法是________(填字母)。
A.热分解法
B.热还原法
C.电解法
D.湿法冶金
(2)实验开始后,B中的现象是____________________,A中反应的化学方程式是________________________________________________________。
(3)写出铝和Fe2O3?反应的化学方程式????????????????????????演示实验引发该反应的方法是????????????????????????????????????????????????????????????????????????
(4)若样品的质量为3.6 g,通入足量的CO充分反应后,B增重2.64 g,则样品中铁的质量分数为_____??????_?? (结果保留一位小数)。
参考答案:(1)B????? (2)有白色沉淀生成;Fe2O3+3CO
本题解析:(1)CO具有还原性,答案选B。
(2)CO的氧化产物是CO2,CO2能和氢氧化钙溶液反应生成白色沉淀。CO还原氧化铁的方程式为Fe2O3+3CO2Fe+3CO2。
(3)铝也具有还原性,能发生铝热反应,方程式为 Fe2O3+2Al2Fe+Al2O3。
(4)B增重2.64 g,说明CO2是2.64g,物质的量是0.06mol。因此根据方程式可知生成铁是0.04mol,所以样品中铁的质量分数为0.04mol×56g/mol÷3.6g×100%=62.2%。
本题难度:一般
5、计算题 用铜和浓硫酸反应,得到SO2的体积为2.24L(标准状况)。
(1)试计算被还原的硫酸的物质的量。
(2)将得到的CuSO4溶液加水配成500ml溶液,则500mlCuSO4溶液中CuSO4的的物质的量浓度是多少?
参考答案:(6分)(1)0.1mol????(2)0.2mol·L-1
本题解析:
试题分析:(1)浓硫酸被还原生成二氧化硫,因此被还原的硫酸的物质的量等于二氧化硫的物质的量,即2.24L÷22.4L/mol=0.1mol。
(2)根据反应式Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑可知 CuSO4+2H2O+SO2↑可知
生成的硫酸铜的物质的量等于SO2的物质的量,都是0.1mol
所以硫
本题难度:一般
|