微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业制备纯硅的反应:SiCl4 (g)+2H2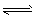 (g)Si(s)+4HCl(g) △H =Q(Q>O),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 [???? ]
(g)Si(s)+4HCl(g) △H =Q(Q>O),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 [???? ]
A.只要时间足够长,SiCl4可完全转化为Si
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为Q
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0. 025QkJ时,生成的HCl通入100mL 1mol·L-1的NaOH中恰好反应
2、填空题 Ⅰ将一定质量的铁粉加入到装有100mL某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有mg的铁粉,收集到NO气体448mL(标准状况下)。
① 所得溶液中的溶质的化学式是_______________;
② 原硝酸溶液的物质的量浓度为:________________mol/L
(2)向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉ng。
①此时溶液中溶质的化学式是__________;
②m-n的值为_____________g 。
Ⅱ:向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间的变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知t3~t4阶段为使用催化剂[已知
t0~ t1阶段c ( B)未画出]。
(3)若 t1=15s ,则t0~ t1阶段以C浓度变化表示的反应速率为________________;

(4)t4~t5阶段改变的条件为____________,B的起始物质的量为______________;
(5)t5~t6阶段容器内A的物质的量共减少0. 03mol ,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式________________________。
3、选择题 相同温度下,体积均为0.25?L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g)??△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表
2NH3(g)??△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表

下列叙述错误的是????[???? ]
A.容器①、②中反应的平衡常数相等?
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15?kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
4、填空题 在一定温度下,将2molN2和6molH2充入固定容积的密闭容器中,发生
 N2(g)+3H2(g)??????????2NH3(g),达到化学平衡后,若保持温度不变,令a、b、c分别为N2、H2、NH3的物质的量,重新建立平衡,混合物中个物质的量仍和上述平衡相同,填空
N2(g)+3H2(g)??????????2NH3(g),达到化学平衡后,若保持温度不变,令a、b、c分别为N2、H2、NH3的物质的量,重新建立平衡,混合物中个物质的量仍和上述平衡相同,填空
(1)若a=0,b=0,则c="———???????"
⑵、若a=1, c =2,则 b =————
⑶、若a、 b 、 c取值必须满足的一般条件为(用两个式子表示,一个只含a和c,一个只含b和c )————————、?? ————————。
5、填空题 (12分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ?2NO2(g)体系中,n(NO)随时间的变化如下表:
?2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
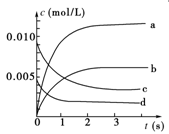
(1)写出该反应的平衡常数表达式:K=________。已知:K300 ℃>K350 ℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_____????????___。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向逆反应方向移动的是________。
a.及时分离出NO2气体????????? b.适当升高温度
c.增大O2的浓度?????????????? d.选择高效催化剂
|