6mol·L-1
此时反应的正、逆反应速率的关系是:v(正)???????v(逆)(填“>”、“="”" 或“<”)。
(5)如图1所示,甲为恒容密闭容器,乙为恒压密闭容器。在甲、乙两容器中分别充入等物质的量的H2和CO,使甲、乙两容器初始容积相等。在相同温度下发生上述反应,并维持反应过程中温度不变。在图2中标出甲、乙两容器中CO的转化率随时间变化的对应图像(在图2相应曲线右侧的框格中分别标注“甲”、“乙”)。
参考答案:(14分)
(1)CDE(2分)
(2)① &l
本题解析:
试题分析:(1)A、CH3OH的生成速率与CO的消耗速率都表示正反应速率,自始至终反应速率都按1:1进行,不能说明到达平衡,故A错误;
B、都为气体,容器的体积不变,混合气体的总质量不变,密度自始至终为定值,不能说明可逆反应到达平衡,故B错误;
C、混合气体的总质量不变,随反应进行,混合气体的总的物质的量减小,即平均相对分子质量减小,最后为定值,说明可逆反应到达平衡状态,故C正确;
D、CH3OH、CO、H2的浓度都不再发生变化,说明可逆反应到达平衡状态,故D正确;
E、反应前后体积不相等,压强不变可作为判断化学平衡的依据,故E正确。
故选:CDE;
(2)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②设一氧化碳的变化量为x,则
CO(g)+2H2(g)?CH3OH(g)
初始浓度(mol/L) 1 3 0
变化浓度(mol/L) 0.8 1.6 0.8
平衡浓度(mol/L) 0.2 2.4 0.8
则CO的转化率=0.8/1×100%=80%,平衡常数K= c(CH3OH)/ (c (CO]c(H2)2) =0.8/(0.2×2.42) =2.04,对照表,温度为250℃。
故答案为:80%;250℃;
(3)a.升高温度,平衡向逆反应移动,平衡时CO的转化率减小,故a错误;
b.加入催化剂,缩短到达平衡时间,平衡不移动,CO转化率不变,故b错误;
c.增加CO的浓度,平衡向正反应移动,平衡时CO的转化率减小,故c错误;
d.加入H2加压,平衡向正反应移动,平衡时CO的转化率增大,故d正确;
e.分离出甲醇,平衡向正反应移动,平衡时CO的转化率增大,故e正确;
f.加入惰性气体加压,反应混合物的浓度不变,变化不移动,故f错误。
故选:de;
(4)K=6/(0.5*22)=3,而平衡使K=2.401,故生成物的浓度大,即v(正)<v(逆)。
(5)甲、乙两容器中分别充入等物质的量的H2和CO,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CO(g) + 2H2(g)  ?CH3OH(g),其体积减小,则相当于压强增大,化学平衡向正反应方向移动,乙容器中CO的转化率增大,但压强大,反应速率快,则达到平衡的时间变短,CO的转化率随时间变化的图象为 ?CH3OH(g),其体积减小,则相当于压强增大,化学平衡向正反应方向移动,乙容器中CO的转化率增大,但压强大,反应速率快,则达到平衡的时间变短,CO的转化率随时间变化的图象为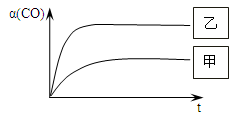 。 。
点评:本题考查平衡状态判断、平衡移动、平衡常数、反应速率计算、热化学方程式、原电池、化学平衡图象等,是化学反应速率与化学平衡的综合题目,难度不大,注重基础知识的考查,(4)中电极反应式的书写为难点、易错点,可以先写出较为简单的正极反应式,利用总反应式减去正极反应式即为负极反应式。
本题难度:一般
2、选择题 一定温度下,反应N2(g)+3H2(g) 2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g) 2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g) 2N2(g)+6H2(g)反应热和化学平衡常数为(???? ) 2N2(g)+6H2(g)反应热和化学平衡常数为(???? )
A.2△H和2K
B.-2△H和 K2
C.-2△H和 K-2
D.2△H和-2K
参考答案:C
本题解析:反应热和化学计量数成之比,即反应热是-2△H;平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,选项C正确,答案选C。
本题难度:简单
3、选择题 在密闭容器中进行如下反应:X2(g)+3Y2(g) 2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( ) 2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
A.X2为0.3 mol·L-1,Y2为0.9 mol·L-1
B.Y2为1.0 mol·L-1
C.X2为0.3 mol·L-1,Z为0.2 mol·L-1
D.Z为1.0 mol·L-1
参考答案:D
本题解析:化学平衡研究的是可逆反应,故解这类题目时要善于利用极值法;另外,此题的易错点是在将选项中所有物质浓度列出来时,易忽略物质的量是否守恒。此题的解法为:
X2(g)+3Y2(g) 2Z(g) 2Z(g)
0.2??????? 0.6??????? 0.4
0????????? 0????????? 0.8(设反应正向进行彻底)
0.4??????? 1.2??????????????????? 0(设反应逆向进行彻底)
据可逆反应的含义知:0<c(X2)<0.4 mol·L-1;0<c(Y2)<1.2 mol·L-1;0<c(Z)<0.8 mol·L-1。
本题难度:一般
4、选择题 相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)  2XY3(g)? ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是 2XY3(g)? ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是
容器编号
| 起始时各物质物质的量(mol)
| 达平衡时体系能量的变化
| ?? X2
| ? Y2
| XY3
| ①
| 1
| 3
| 0
| 放热 23.15 kJ
| ②
| 0.6
| 1.8
| 0.8
| Q (Q>0)
A.容器①、②中反应的平衡常数相等
B.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C.容器②中反应达到平衡时放出的热量为Q=23.15 kJ
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
参考答案:C
本题解析:
试题分析:平衡常数只与温度有关系,A正确;②相当于是1molX2和3molY2,所以二者的平衡状态是等效的,因此根据放出的热量可知,消耗X2的物质的量是23.15 kJ÷92.6 kJ·mol-1=0.25mol,所以生成物的物质的量是0.5mol,则其浓度是0.5mol÷0.25L=2mol/L,B正确;C不正确,放出的热量小于23.15 kJ;增大压强平衡向正反应方向越多,所以放出的热量大于23.15 kJ,D正确,答案选C。
点评:该题的关键是根据起始物质的物质的量判断出二者的平衡是等效的,然后在依据有关条件分析、计算即可。
本题难度:一般
5、选择题 对于反应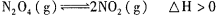 ,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
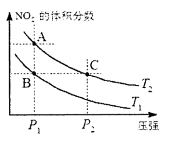
A. 两种不同的温度比较:T1>T2
B. A、C两点的反应速率:A〉C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法实现
参考答案:D
本题解析:
试题分析:A.反应为吸热反应,升高温度平衡正向移动,在压强为P1时,由B点到A点,NO2的体积分数增大,即T2>T1,故A错误;
B.由图象可知,A、C两点都在等温线上,C的压强大,则A、C两点的反应速率:A<C,故B错误;
C.由图象可知,在B、C两点时NO2的体积分数相等,气体的平均相对分子质量:B=C,故C错误;
D.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故D正确;
故选D。
点评:本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答,难度不大.注意B选项为易错点,改变压强的本质为体积变化。
本题难度:一般
|
|