微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列热化学方程式或说法正确的是 [???? ]
A.甲烷的燃烧热为△H=-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+
2H2O(g) △H=-890 kJ/mol
B.500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)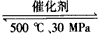 2NH3(g) △H=-38.6 kJ/mol
2NH3(g) △H=-38.6 kJ/mol
C.已知:H2(g)+F2(g)=2HF(g) △H= -270 kJ/mol,则1mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
D.在C中相同条件下,2 mol HF气体的能量小于1 mol 氢气与1mol氟气的能量总和
参考答案:D
本题解析:
本题难度:简单
2、选择题 有关键能(破坏1 mol共价键吸收的能量)数据如表
化学键
| Si—O
| O===O
| Si—Si
|
键能/kJ·mol-1
| X
| 498.8
| 176
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·mol-1,则X的值为(已知1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键)
A.423.3 B.460 C.832 D.920
参考答案:B
本题解析:
试题分析:根据反应热=反应物的键能总和-生成物的键能总和分析,2×176+498.8-4x=-989.2,解x=460,选B。
考点: 反应热的计算
本题难度:一般
3、选择题 工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应.现将2mol?SO2、1mol?O2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2的物质的量为1mol.则下列热化学方程式正确的是( ? ) A.2SO2(g)+O2(g)?2SO3(g)△H=-196.6?kJ?mol-1
B.2SO2(g)+O2(g)?2SO3(g)△H=-98.3?kJ?mol-1
C.SO2(g)+1/2O2(g)?SO3(g)△H=+98.3?kJ?mol-1
D.SO2(g)+1/2O2(g)?SO3(g)△H=+196.6?kJ?mol-1
参考答案:A
本题解析:
本题难度:简单
4、填空题 (15分)
(1)已知:
甲醇制烯烃反应①:2CH3OH(g)=C2H4 (g)+2H2O(g)?△H1=-29.0 KJ·mol-1
甲醇脱水反应②:2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H2=-24.0 KJ·mol-1
乙醇异构化反应③:CH3CH2OH(g)=CH3OCH3(g))?△H3=+50.8 KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H= KJ·mol-1
(2)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ、通入氨,冷却、加食盐,过滤;Ⅱ、不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是 。而方法Ⅱ的优点是其滤液可以 。
(3)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 :PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式 ,电解液中加入Cu(NO3)2的原因是 。
参考答案:(14分) (1)-45.8
(2) ①NH4HCO3
本题解析:
试题分析:(1)根据盖斯定律,②-①-③可得所求热化学方程式,则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H=②-①-③=(-24.0+29-50.8)kJ/mol=-45.8kJ/mol;
(2)①根据物质溶解度的不同,氯化钠的溶解度大于碳酸氢钠的溶解度,所以向饱和的氯化钠溶液中加入碳酸氢铵,则生成碳酸氢钠沉淀和氯化铵,化学方程式是NH4HCO3+NaCl→NaHCO3↓+NH4Cl;
②I与II的区别在于是否通入氨气,而通入氨气,则氯化铵的浓度增大,加入食盐后,发生盐析,有利于氯化铵的析出;而方法I过滤后的溶液中含有氨气,所以不能循环使用,方法II过滤后的溶液为氯化钠,可直接循环使用;
(3)PbO与次氯酸钠反应生成PbO2,Pb元素的化合价升高,则Cl元素的化合价降低,所以次氯酸根离子被还原为氯离子,离子方程式是PbO+ClO-= PbO2+Cl-;电解时,阳极发生氧化反应,因为该电解池可制取PbO2,所以阳极是Pb2+失去电子与水结合生成PbO2,电极反应式是Pb2++2H2O-2e- = PbO2↓+ 4H+;若不加入硝酸铜,则阴极是阳离子放电,则在阴极放电的是Pb2+,生成Pb,所以阳极上得到PbO2的量将减少,Pb2+的利用率降低。
考点:考查盖斯定律的应用,对实验方案的分析,电化学反应原理的应用
本题难度:困难
5、选择题 .已知:①2C(s)+O2(g)====2CO(g) ΔH=-221.0 kJ·mol-1;②2H2(g)+O2(g) ====2H2O(g) ΔH=-483.6 kJ·mol-1。则反应C(s)+H2O(g) ====CO(g)+H2(g)的ΔH为( )
A.+262.6 kJ·mol-1
B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1
D.+131.3 kJ·mol-1
参考答案:D
本题解析:
试题分析:根据盖斯定律可得反应C(s)+H2O(g) ====CO(g)+H2(g)的ΔH=(①-②)/2=(483.6-221)/2=+131.3kJ/mol,答案选D。
考点:考查盖斯定律的应用
本题难度:一般
|