微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是: ;
②写出由CaCl2通过化合反应制备CaCl的化学方程式: 。
参考答案:(1)①常温下,浓硝酸可使铝表面形成致密的氧化膜而钝化(2分
本题解析:
试题分析:(1)①常温下,铝在浓硝酸中钝化,表面形成致密的氧化膜而隔离铝和浓硝酸,所以可用铝制容器存放浓硝酸。
②首先携程H2与NO2反应的化学方程式并注明状态,然后根据盖斯定律求出?H,?H=2?H1-?H2=-1034 kJ·moL-1,可写出热化学方程式:4H2(g) + 2NO2(g)=N2(g) + 4H2O(g) △H=-1034 kJ·moL-1
(2)①反应物为CaCl2和H2,根据元素守恒,生成物乙显酸性,则乙为:HCl;化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,则H元素的质量分数为:1—52.29%—46.41%=1.3%,根据元素质量比可得该化合物的化学式为:CaHCl,与水反应生成H2的反应为:2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑
②Ca具有强还原性,可与CaCl2反应生成CaCl,化学方程式为:Ca + CaCl2=2CaCl
考点:本题考查物质的保存、热化学方程式和化学方程式的书写、物质的推断。
本题难度:一般
2、选择题 一定条件下的密闭容器中:4NH3(g)+5O2(g)

4NO(g)+6H2O(g)△H=-905.9kJ?mol-1,下列叙述正确的是( )
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时v正(O2)=
4
5
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
参考答案:D
本题解析:
本题难度:简单
3、选择题 已知:①H2O(g)=H2O(l) △H1=-Q1 kJ·mol—1;
②C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ·mol—1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ·mol—1
若使23g酒精液体完全燃烧,生成稳定的氧化物,最后恢复到室温,则放出的热量是多少kJ( )
A.Q1+ Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5 Q1-1.5 Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3
参考答案:D
本题解析:
试题分析:根据题意,求C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的△H,根据盖斯定律可得,该反应的△H=③-②+3①=-(Q3- Q2+3 Q1),23g乙醇的物质的量是0.5mol,所以放出的热量是(Q3- Q2+3 Q1)的1/2,即1.5Q1-0.5Q2+0.5Q3,答案选D。
考点:考查化学反应热效应的计算
本题难度:一般
4、填空题 (1)已知:2SO2(g)+O2(g)?2SO3?(g)△H=-196.6kJ?mol-1;2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1 .则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=______kJ?mol-1
一定条件下,将NO2与SO2?按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______.
a.体系压强保持不
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H______0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______
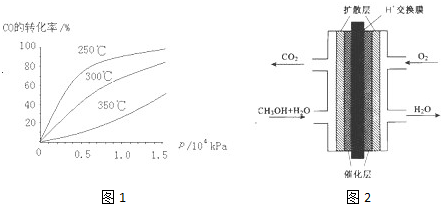
(3)甲醇(CH3OH)燃料电池的结构示意图如图2.甲醇进入______极(填“正”或“负”),正极发生的电极反应为______.
(4)101kPa时,若16gCH3OH完全燃烧生成液态水,放出热量为363.25kJ/mol,则甲醇燃烧的热化学方程式为______.
参考答案:(1)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相
本题解析:
本题难度:一般
5、选择题 化学反应N2+3H2=2NH3的能量变化如下图所示,该反应的热化学方程式是
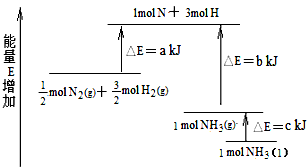 [???? ] [???? ]
A.N2(g)+3H2(g) = 2NH3(l) ⊿H = 2(a-b-c)kJ/mol
B.N2(g)+3H2(g) = 2NH3(g) ⊿H = 2(b-a)kJ/mol
C.1/2N2(g)+3/2H2(g) =NH3(l) ⊿H = (b+c-a)kJ/mol
D.1/2N2(g)+3/2H2(g) =NH3(g) ⊿H = (a+b)kJ/mol
参考答案:A
本题解析:
本题难度:简单
|