微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答:
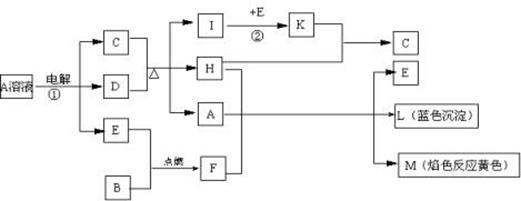
⑴L的化学式:???????????????F的电子式:????????????。
⑵反应①的离子方程式:???????????????????????????????????????。
⑶反应②,工业上采取的反应条件:??????????????????????????????。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
???????????????????????????????????????????????。
参考答案:⑴Cu(OH)2? 本题解析:
本题解析:
试题分析:(1)L是蓝色沉淀,M的焰色反应是黄色,H常温下为无色液体,判断H是水;说明A、F中含有Na、Cu元素,所以B是Na或是Cu;A、F与水反应生成钠的化合物、蓝色沉淀及E, 判断E是氧气,将Cu代入,不符合题意,所以B是Na,F是过氧化钠;C与D加热反应生成3种物质,I与氧气反应的产物K与水反应又得C,所以A是硫酸铜溶液,过氧化钠与水反应生成氧气和氢氧化钠,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀,所以L是Cu(OH)2,过氧化钠的电子式为 本题难度:一般
本题难度:一般
2、填空题 (13分)已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
Y溶液
?
 (1)步骤 (1)步骤 1的主要操作是????????,需用到的玻璃仪器有???????, _______、????????。 1的主要操作是????????,需用到的玻璃仪器有???????, _______、????????。
(2)步骤2中发生反应的离子方程式为???????????????????????????????
(3)步骤3中加入的Y溶液是????????????(填化学式)
(4)步骤4中涉及的操作是:蒸发浓缩.?????????????.过滤.洗涤.烘干。
(5)实验室要配制100mL1.0mol·L-1 FeSO4溶液,经计算,应该用托盘天平称取FeSO4·7H2O固体????????g。
参考答案: 本题解析:略 本题解析:略
本题难度:困难
3、选择题 下列各图示中能较长时间看到Fe(OH)2白色沉淀的是?? ( )。

A.①②③④⑤
B.①②③⑤
C.①②③④
D.②③④⑤
参考答案:B
本题解析:因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,即发生4Fe(OH)2+O2+2H2O=4Fe(OH)3。因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③的原理为铁作阳极产生Fe2+,与电解水产生的OH-结合生成Fe(OH)2,且液面用汽油保护,能防止空气进入;⑤中液面加苯阻止了空气进入;④由于空气中的氧气,能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀。
本题难度:一般
4、实验题 (12分)某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体与Fe3+反应的主要产物是__???????????__?????????????。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是??????????????????????????。
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与热浓H2SO4
(3)装置C的作用是???????????????????????????????????????????????????。
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为???????mol/L才能达到目的。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是????????,原因是????????????????????????????????????????????????。
(6)能表明I—的还原性弱于SO2的现象是??????????????????????????????????????,写出有关离子方程式:?????????????????????????????????????????????????????。
参考答案:(1)SO42-、Fe2+(2分)????????(2)BD
本题解析:
试题分析:(1)SO2具有还原性,铁离子具有氧化性,二者发生氧化还原反应,即2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,所以SO2气体还原Fe3+反应的产物是Fe2+,SO42-。
(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错;B、浓硫酸虽具有强氧化性,但不能氧化亚硫酸钠,能和亚硫酸钠反应生成SO2,故B正确;C、固体硫在纯氧中燃烧,操作不容易控制,故C错;D、铜与浓硫酸反应的离子方程式为Cu+2H2SO4(浓) 本题难度:一般 本题难度:一般
5、计算题 现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):
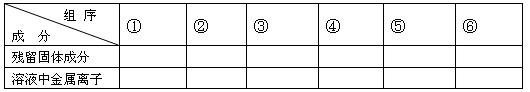
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值。
参考答案:(1)
??????组序
成?分
①
本题解析:略
本题难度:一般
|