微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) ="=" Cu2+(aq) + H2(g)? △H= +64.39kJ/mol
2H2O2(l) ="=" 2H2O(l) + O2 (g)? △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)="=" H2O(l)? △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
??????????????????????????????????????????????
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围???????????????,向反应后溶液中加入4mol/L NaOH溶液???????ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为????ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量??????????g。(用含a的代数式表示)
参考答案:(1)? Cu(s) +2H+ (aq) + H2O2
本题解析:略
本题难度:一般
2、填空题 (15分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
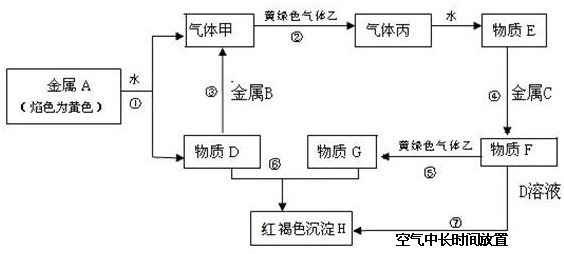
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A___________、F___________、H___________。
(2)说出黄绿色气体乙的一种用途___________。
(3)反应⑤的离子方程式为____________。
(4)反应过程⑦可能观察到的实验现象___________。
(5)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为_________________________。
参考答案:(1)A:Na、 F:FeCl2、 H:Fe(OH)3。
本题解析:略
本题难度:简单
3、选择题 将金属Mg、Fe的混合物16 g投入到200 mL的稀硫酸中,恰好完全反应,收集到标准状况下11.2 L氢气。下列相关说法错误的是?(???)
A.Mg、Fe混合物总物质的量为0.5 mol
B.Mg与Fe物质的量之比为3︰1
C.生成MgSO4的质量为45 g
D.该稀硫酸物质的量浓度为0.5 mol/L
参考答案:D
本题解析:略
本题难度:简单
4、填空题 目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。?
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
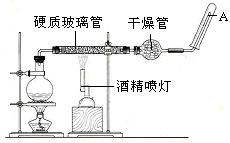
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式:???????????????????????????????????????;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为?????????????
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
?
| ①
| ②
| ③
| ④
|
溶液中的金属离子
| ?
| Fe2+
| ?
| ?
|
残留固体成分
| Fe、Pt
| ?
| Pt
| Pt
?
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a =??????????,b =?????????????,
参考答案:(1)第四周期,第Ⅷ 族????? (1分)
(2)3
本题解析:
试题分析:(1)Fe在元素周期表中位于第四周期,第Ⅷ 族。
(2)Fe与H2O(g)反应生成Fe3O4和H2,化学方程式为:3Fe+4H2O(g)  Fe3O4+4H2 Fe3O4+4H2
(3)铝和铁的氧化物反应原理来焊接钢轨,化学方程式为:2Al+Fe2O 3 本题难度:一般 本题难度:一般
5、填空题 (本题共13分)甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤
| 操作
| 现象
| Ⅰ
| 向2mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液
| 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,请用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,其中Fe3+ →Fe2+ ;请写出Fe3+ 跟SO32-反应的离子方程式
______________。
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤
| 操作
| 现象
| Ⅱ
| 用激光笔照射步骤I中的红褐色溶液
| 出现“丁达尔效应”
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤
| 操作
| 现象
| Ⅲ
| 向1 mol?L-1的FeCl3溶液中通入一定量的SO2
| 溶液由黄色变为红褐色
| Ⅳ
| 用激光笔照射步骤Ⅲ中的红褐色溶液
| 没有出现“丁达尔效应”
① 经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液?????????b.KSCN溶液????????c.KMnO4溶液
② 请用离子方程式和必要的文字说明步骤Ⅲ中出现红褐色的原因???????。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
参考答案:(1)<(1分) (2) ① Fe3++3H2O![]()
本题解析:
试题分析:(1)氯化铁是强酸弱碱盐,铁离子水解溶液显酸性,因此常温下,FeCl3溶液的pH<7。
(2)① 在氯化铁溶液中存在铁离子的水解平衡:Fe3++3H2O Fe(OH)3+3H+,加入Na2SO3后,消耗氢离子,溶液中c(H+)下降,平衡正向移动,生成Fe(OH)3。 Fe(OH)3+3H+,加入Na2SO3后,消耗氢离子,溶液中c(H+)下降,平衡正向移动,生成Fe(OH)3。
②铁离子具有氧化
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|