微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 已知Fe2O3与H2反应会因温度不同而可能有Fe3O4生成。某化学兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验:
(1)甲同学认为黑色粉末X能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是___________________________。
(2)乙同学先将少量黑色粉末X加入装有足量硫酸铜溶液的烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣中加入盐酸,再滴加几滴KSCN溶液,溶液出现红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4。
①滴加KSCN溶液的目的是_____________________。
②若将粉末X直接加入盐酸中,再加KSCN溶液,溶液不出现红色,则不出现红色的原因是(用离子方程式表示) _____________。
(3)丁同学的实验方案:
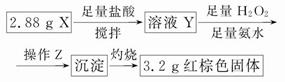
①操作Z是__________________。
②通过以上数据,得出2.88 g黑色粉末X中各成分的物质的量为____________________________________。
参考答案:(1)Fe3O4也能被磁铁吸附,故不能由此确定X就是铁单质<
本题解析:①通过操作Z得到沉淀,所以该操作是过滤、洗涤;②由题意,n(Fe)×56+n(Fe3O4)×232=2.88,[n(Fe)+3n(Fe3O4)]×160/2=3.2。解得:n(Fe)=0.01 mol,n(Fe3O4)=0.01 mol
本题难度:一般
2、填空题 (18分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe?3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是???????????????????;X与过量浓硝酸反应后溶液中含有的盐的化学式为????????????????。
(2)某溶液中有Mg2+、Fe2 +、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐
+、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐 酸中,所得溶
酸中,所得溶 液与原溶液相比,溶液中大量减少的阳离子是????????????????;
液与原溶液相比,溶液中大量减少的阳离子是????????????????;
A.Mg2+???????????????B.Fe2+????????????????????C.A13+????????????????????D.Cu2+
(3)氧化铁是重要工业颜料,用废秩屑制备它的流程如下:

回答下列问题:
①操作I的名称是???????????,操作II的名称是???????????????????;操作III的
方法为???????? ?????????????????????????。
?????????????????????????。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)???????????????;
③请完成生成FeCO3沉淀的离子方程式???????????????????。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定
(5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需????????。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是????????。
A.稀硝酸???? B.稀盐酸??????? C.稀硫酸????????? D.浓硝酸
③某同学设计的下列滴定方式,最合理的是?????。(夹持部分略去)(填字母序号)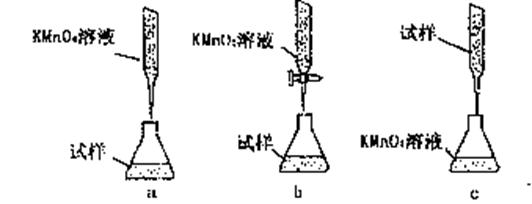
参考答案:[(1)Fe2+、Fe3+、H+;Fe(NO3)2;(每空2
本题解析:略
本题难度:简单
3、选择题 将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热,充分反应后过滤,弃去滤渣,滤液中金属阳离子情况不可能是
A.只含Cu2+、Fe2+、Zn2+
B.只含Zn2+
C.只含Fe2+、Zn2+
D.只含Cu2+、Fe3+、Zn2+
参考答案:D
本题解析:
试题分析:微热,充分反应后过滤,弃去滤渣,说明金属有剩余,溶液中一定不能含有Fe3+,故D不可能。
本题难度:一般
4、实验题 某化学小组用下列装置对铁及其化合物的性质进行探究,回答有关问题:
(1)该小组同学想制得氢氧化亚铁并保存较长时间,按如图(a)所示装置对其进行操作。
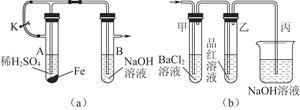
①某同学的操作是:先夹紧止水夹K,再使A管开始反应,实验中在B管中观察到的现象是???????????????????????????????????????????????????????????????????????
???????????????????????????????????????????????????????????????????????。
②为达到实验目的,正确的操作是???????????????????????????????????????????????????????????????????????。
B管中发生反应的离子方程式是???????????????????????????????????????????????????????????????????????。
(2)当上述装置的实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后得到FeSO4,再高温煅烧(有关装置和操作均已略去),最后留下红棕色固体,将分解时产生的气体按图(b)所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
①用方程式表示试管甲产生白色沉淀的原因???????????????????????????????????????????????????????????????????????
?????????????????。
②为验证红棕色固体成分,可进行如下操作???????????????????????????????????????????????????????????????????????
???????????????????????????????????????????????????????????????????????。
③图(b)中丙装置的作用是???????????????。
④根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生反应的化学方程式?????????????????????????????????????。
参考答案:(1)①A中溶液进入B中,开始产生白色沉淀,然后变为灰绿色,
本题解析:(1)由装置a看出,实验的原理为先使铁与稀硫酸反应生成H2和FeSO4,打开止水夹K,使生成的H2将装置内空气全部排出后关闭止水夹,H2产生的压力将A管中的FeSO4溶液“压”入B管中,产生Fe(OH)2白色沉淀,处于H2的保护中,能保持较长时间不变色。
(2)试管甲能产生白色沉淀,说明一定产生了SO3,SO2不与BaCl2溶液反应,故乙装置的作用是检验SO2,而丙装置的作用是吸收SO2,防止污染。根据题意,加热FeSO4固体时产生SO2、SO3和Fe2O3,再结合电子守恒可写出反应的化学方程式。
本题难度:困难
5、选择题  为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
方案Ⅰ:铜铝混合物??????????????测定生成气体的体积

?
方案Ⅱ:铜铝混合物??????????????测定剩余固体的质量
回答下列问题:
⑴小组成员一致认为两个方案都可行,你认为在实验室中选择方案???????更便于实施。
⑵小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是?????????????????。(填编号)
A.稀盐酸??????? B.氢氧化钠溶液??????? C.硫酸铜溶液
⑶小组成员为探究Cu2+、Al3+在溶液中是否可以依次转化为沉淀而析出,设计了如下实验:向含有0.01molHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定浓度的NH3H2O溶液,使混合溶液的PH值不断升高,当加至溶液的体积为45mL时Al3+开始反应生成成沉淀,当加至溶液的体积为50mL时Cu2+开始反应生成沉淀。(不考虑溶液的体积变化)
【查阅资料】:常温下Ksp[Al(OH)3]=1.0×10-33mol·L-4,Ksp[Cu(OH)2]=2.0×10-20mol·L-3。
①Al(OH)3开始析出时溶液的PH值?
②若溶液中离子的浓度约为1.0×10-5 mol·L-时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出?
参考答案:⑴Ⅱ?
⑵AB
⑶①(计算到)c(OH-)=1
本题解析:(1)在中学实验条件下测质量比测气体体积所受的干扰少,精度较高。
(2)易判断,CuSO4溶液与铝会发生置换反应,生成铜单质,这样测出的铜就不是原有的铜了。
(3)根据Ksp[Al(OH)3] = c3(OH-).c(Al3+)即可算出c(OH-)从而算出PH.=3
根据Ksp[Cu(OH)2]=2.0×10-20mol·L-3,c(Cu2+) 已知 ,可算出PH=5时,Cu(OH)2开始析出
根据Ksp[Al(OH)3] = c3(OH-), c(Al3+)=1.0×10-5
本题难度:一般
|