微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:
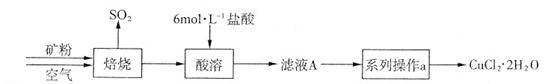
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有??????、???????。
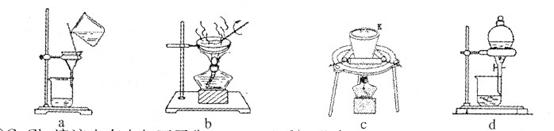
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是???(填下列各项中序号)。
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是??????(填下列各项中序号)。
a.FeCl3固体 ???????b.CuCl2固体 ??????c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。
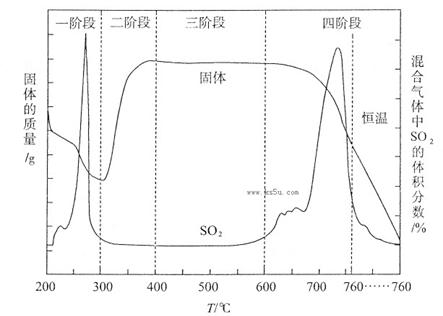
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为:

第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为???????????????????????????????????????????????????????????????。
②300~400oC范围内,固体质量明显增加的原因是???????????,上图所示过程中,CuSO4固体能稳定存在的阶段是???(填下列各项中序号)。
a.一阶段??? b、二阶段??? c、三阶段? d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
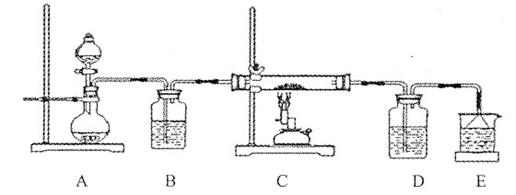
a.装置组装完成后,应立即进行的一项操作是????????????????。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为???????溶液。
c.若原CuS矿样的质量为l0.0 g,在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.0 g,则原矿样中CuS的质量分数为??????。
参考答案:(1)(4分)胶头滴管(2分)? 500mL容量瓶(2分)<
本题解析:
试题分析:(1)由浓盐酸配制稀盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还需要:胶头滴管、500mL容量瓶。
(2)①由CuCl2溶液制取CuCl2?2H2O,需要进行蒸发浓缩、降温结晶,然后过滤可得CuCl2?2H2O晶体,所以不需要c、d操作。
②FeCl3溶液为黄色,CuCl2溶液为蓝色,对原平衡体系溶液的颜色产生干扰,而加入蒸馏水可使平衡向逆反应方向移动,溶液的颜色发生改变,可证明滤液A(绿色)中存在上述平衡,故c项正确。
(3)①根据流程图CuS与O2反应生成Cu2S,还
本题难度:困难
2、填空题 在FeSO4溶液中加入NaOH溶液的反应现象是:______,方程式有:______,______.
参考答案:在FeSO4溶液中加入NaOH溶液,先生成白色絮状沉淀,反应
本题解析:
本题难度:一般
3、填空题 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
⑴超细铜粉的某制备方法如下:

①[Cu(NH3)4]SO4中所含的化学键有?????、?????、??????,
N、O、S三种元素的第一电离能大小顺序为:?????>?????>??????。(填元素符号)
②NH4CuSO3中的金属阳离子的核外电子排布式为:????????????????????????。
③? NH3分子中N原子的杂化方式为:?????????????。
④与SO2互为等电子体的分子有????????????????(写一种)。
⑵氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通人一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
①CuCl的晶胞结构如下图所示,其中Cl原子的配位数为_________。
②CuCl的熔点比CuO的熔点???????????。(填“高”或“低”)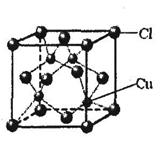
参考答案:⑴①?离子键 、?共价键 、 配位键 ,? N?>? O?>
本题解析:略
本题难度:简单
4、填空题 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
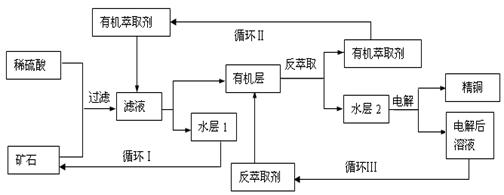
?
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混
合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1) 矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O、
????????????????????????????????????、??????????????????????????????????(任写其中2个)。
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体
的化学式是?????????????。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写
出水层1暴露在空气中发生反应的离子方程式???????????????????????????????????。
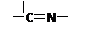 (3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分 (3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
子结构中仅含n1个 —CH3、n2个 —OH 和n3个??????????三种基团,无环状结构,三种基团的数
目关系为n3=?????????????。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,
则A的结构简式是??????????????????????????????。
(4) 写出电解过程中阳极(惰性电极)发生反应的电极反应式:???????????????????????????。
(5)“循环Ⅲ”中反萃取剂的主要成分是???????????????????。
参考答案:(1) CuO+2H+==Cu2++H2O、Fe2O3+6H
本题解析:本题看似考察酸浸法从矿石中提取铜这样一个复杂的工艺流程,实际上考察了常见金属及其化合物的性质(1、2两问)、电解精炼铜(4、5两问)及对有机物结构的体认(3) 。
(1)由矿石成分知氧化铜、氧化铁与硫酸反应。
  本题难度:一般 本题难度:一般
5、计算题 (6分)某实验人员做了下列实验:将一定量1.00mol/L CuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将4.54g X隔绝空气在1000℃以上强热,得到一种红色固体Cu2O,质量为2.88g。经分析发现X中含SO42—。试通过计算确定X的化学式。
参考答案:3Cu(OH)2·CuSO4或Cu4(OH)6SO4
本题解析:根据硫酸铜溶液跟氢氧化钠溶液混合生成沉淀,X中含SO42—,可设沉淀组成为mCu(OH)2·nCuSO4,则有(98m+160n)∶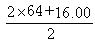 (m+n)=4.54∶2.88(2分) (m+n)=4.54∶2.88(2分)
即可得m∶n=3∶1(2分)所以X为(2分)
本题难度:一般
|