微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子反应方程式正确的是( ? )
A.碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
B.氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
C.硫酸亚铁溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
D.Fe3O4溶于稀硫酸:Fe3O4+8H+=3Fe3++4H2O
参考答案:B
本题解析:
本题难度:简单
2、实验题 (14分)某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。
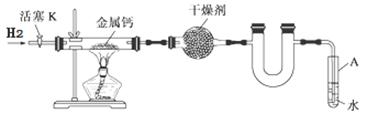
(1)试管A的作用有 ; 。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
② ;
③点燃酒精灯,进行反应;
④反应结束后, ;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、 。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有胶头滴管、烧杯、玻璃棒、量筒、 ;
②判断滴定终点的方法是 ;
③产品中两种成分物质的量之比为 。
参考答案:(14分)
(1)防止反应过程中空气进入反应管(1分)
本题解析:
试题分析:(1)试管A用液体封了导管口,所以能防止反应过程中空气进入反应管;通过氢气的气泡可以观察H2流速。(2)②因为金属钙容易和空气中的氧气反应,所以需要用氢气排除装置中的空气,所以通入氢气,收集气体并检验其纯度。④反应结束后,为了防止氢化钙被氧化,所以先熄灭酒精灯,待反应管冷却至室温,停止通H2并关闭活塞K。(3)氢化钙能和水反应生成氢氧化钙和氢气,方程式为:Ca+2H2O=Ca(OH)2+H2↑。(4)①配制溶液需要使用500mL容量瓶。②锥形瓶中滴加酚酞,溶液显红色,所以滴定的终点为加入最后一滴盐酸,整个溶液由红色变为无色,且半分钟不变色。③盐酸的物质的量为0.2500×0.02200=0.0055mol,所以原来产品中钙的物质的量为0.0055÷2×500÷25=0.055mol,假设钙的物质的量为xmol,氢化钙的物质的量为ymol,则有x+y=0.05540x+42y=2.30,解x=0.005mol,y=0.05mol,所以二者物质的量比为1:10。
考点:物质的制备,中和滴定,实验数据的处理
本题难度:困难
3、填空题 (11分)(1)FeCl3的水溶液呈____(填“酸”、“中”、“碱”)性,实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以____(填“促进”、“抑制”)其水解。
(2)氯化铝溶于水的反应(用离子方程式表示):_______________________;把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是 。
(3)物质的量浓度均为0.10 mol·L-1的三种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3
pH由小到大排列的顺序是 (用编号填写)。
(4)NaHCO3溶液显 性,原因是_______________________(用离子方程式表示)。
参考答案:(1)酸,抑制(各1分) 。
(2)Al3++3H2O
本题解析:
试题分析:(1)FeCl3为强酸弱碱盐,铁离子水解而使其溶液呈酸性:Fe3++3H2O?Fe(OH)3+3H+,为防止Fe3+水解,在配制FeCl3溶液时常将FeCl3固体先溶于稀盐酸中,H+浓度较大,以抑制Fe3+水解;(2)AlCl3属于强酸弱碱盐,水解显酸性:Al3++3H2O?Al(OH)3+3H+,氯化铝水溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧Al(OH)3分解产生Al2O3;(3)a.CH3COONa b.Na2CO3 c.NaHCO3都是强碱弱酸盐,水溶液呈碱性,酸性越弱水解程度越大,对应酸的水解程度大小为CH3COO-<HCO3-<CO32-,溶液中氢氧根离子浓度越大,PH越大,对应PH由大到小的顺序a<c<b;(4)NaHCO3是强碱弱酸盐,HCO3-水解导致溶液呈碱性,水解方程式为HCO3- +H2O H2CO3 + OH-。
H2CO3 + OH-。
考点:考查盐类水解与溶液酸碱性。
本题难度:一般
4、选择题 在NaHCO3溶液中,若采取措施使溶液pH增大的同时,c(CO32-)的变化情况是
A.增大
B.减小
C.不变
D.可能增大,也可能减小
参考答案:D
本题解析:
试题分析:在碳酸氢钠溶液中,若使溶液的pH增大,可以向溶液中加入氢氧化钠,则溶液中的氢氧根离子浓度增大,生成碳酸钠,所以碳酸根离子的浓度增大;也可向碳酸氢钠溶液中加入氢氧化钙,生成碳酸钙沉淀,溶液的pH增大,但碳酸根离子浓度减小,所以答案选D。
考点:考查碳酸氢钠溶液pH的变化对碳酸根离子浓度的影响
本题难度:一般
5、选择题 下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c(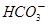 )的值保持增大
)的值保持增大
②浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(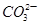 )+c(
)+c(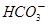 )]
)]
③在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol·L-1
④向0.1mol·L-1(NH4)2SO3溶液中加入少量NaOH固体,c(Na+)、c( )、c(
)、c( )均增大
)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+2c(H2S)+c(HS-)
A.①④
B.②④
C.①③
D.②⑤
参考答案:B
本题解析:
试题分析:①加水稀释,碳酸氢根的水解程度增大,所以比值增大,正确;②在同业中遵循物料守恒,钠原子:碳原子=3:2,所以有2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],错误;③恰好完全反应时,溶液中的氢离子和氢氧根离子都是水电离的,所以溶液的pH=a,则溶液中的氢离子浓度=10-amol/L,则氢氧根离子浓度也为10-amol/L,正确;④加入氢氧化钠固体,促进铵根离子水解,抑制亚硫酸根离子水解,所以铵根离子浓度减小,亚硫酸根离子浓度增大,错误;⑤根据溶液中质子守恒,即水电离的氢离子和氢氧根离子浓度永远相等,可以写出c(H+)=c(OH-)+2c(H2S)+c(HS-),正确;所以选B。
考点:溶液的酸碱性和溶液中的离子浓度比较
本题难度:困难