微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300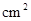 ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
2A(g)+B(g) 2C(g);?H=-180 kJ·
2C(g);?H=-180 kJ·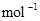
(1)若平均每分钟生成0.5 mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J·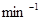 ·
·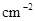 ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
(2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是_____??___。
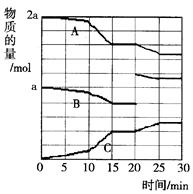
A.10~15 min可能是加入了正催化剂
B.10~15 min可能是降低了温度
C.20 min时可能是缩小了容器体积
D.20 min时可能是增加了B的量
参考答案:(10分)(1)0.25 mol· 本题解析:(1) v=
本题解析:(1) v=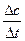 =
=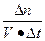 =0.25 mol·
=0.25 mol·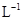 ·
·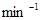
(2)每分钟体系向外散热为:0.400 KJ·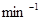 ·
·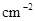 ×300=120kJ
×300=120kJ
而反应本身放热为:180 kJ·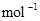 ×2/0.5=45kJ
×2/0.5=45kJ
故为了维持恒温t℃,平均每分钟需用加热器提供120-45=75kJ的热量
(3) 10~15 min时反应速率加快,加入正催化剂符合题意,但降低温度将使反应速率降低;20 min时只有B的量瞬间增大,故可能是增加了B的量,而缩小了容器体积,B的量不会瞬间增大。
本题难度:一般
2、填空题 在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应:3A(g)+B(g) 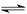 2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
(1)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(2)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。
参考答案:(1)增大????不变??????增大??????不变?(2
本题解析:
试题分析:(1)根据方程式可知,反应前后气体体积是不变的,所以如果缩小反应容器的体积,使压强增大,平衡不移动,但C的浓度是增大的。而C的质量分数不变。密度是混合气的质量和容器容积的比值,混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,由于容器减小,平衡不移动,所以混合气的密度增大,而混合气的平均相对分子质量不变。
(2)C和D各4/3mol,则相当于A和B的物质的量分别是2 mol A和2/3 mol B。由于是温度和容积是不变的,所以要满足平衡等效,对应各物质起始投料的物质的量与原平衡起始态相同,所以还缺少B物质,其物质的量是(2mol-2/3mol)=4/3mol。
点评:在进行等效平衡的有关计算时关键是分清类别,用相应的方法求解即可。
本题难度:一般
3、选择题 在可逆反应2A(g) + B(g) 2C(g)?? △H<0中,为了有利于A的利用,应采用的反应条件是(??)
2C(g)?? △H<0中,为了有利于A的利用,应采用的反应条件是(??)
A.高温、高压
B.高温、低压
C.低温、低压
D.适当温度、高压
参考答案:D
本题解析:略
本题难度:简单
4、填空题 水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH="+131" kJ·mol-1
CO (g)+H2 (g) ΔH="+131" kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
容器
编号
| c(H2O)
/mol·L-1
| c(CO)
/mol·L-1
| c(H2)
/mol·L-1
| v正、v逆比较
|
Ⅰ
| 0.06
| 0.60
| 0.10
| v正=v逆
|
Ⅱ
| 0.06
| 0.50
| 0.40
| ①
|
Ⅲ
| 0.12
| 0.40
| 0.80
| v正<v逆
|
Ⅳ
| 0.12
| 0.30
| ②
| v正=v逆
?
① ,② ??????????????????????????。?
在T温度下该反应的化学平衡常数为 ? 。?
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0 mol碳和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 碳,水蒸气的转化率将 (填 “增大”、“减小”或“不变”)。?
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)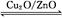 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。? CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。?
参考答案:(1)①v正<v逆 ②0.40 1.00
(2)
本题解析:(1)根据Ⅰ可知,K=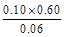 =1.00,Ⅱ中Q= =1.00,Ⅱ中Q=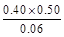 = =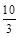 >K,所以反应向逆反应方向移动,即正反应速率小于逆反应速率。在Ⅳ中反应处于平衡状态,设c(H2)="a" mol·L-1,则 >K,所以反应向逆反应方向移动,即正反应速率小于逆反应速率。在Ⅳ中反应处于平衡状态,设c(H2)="a" mol·L-1,则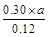 =1.00,解得a=0.40。 =1.00,解得a=0.40。
(2) C(s)+H2O(g) CO(g)+H2(g) CO(g)+H2(g)
起始量(mol) ??? 1.0
转化量(mol) ??? x???????? x??? x
平衡量(mol) ??? 1.0-x????? x????????? x
所以有1.0-x+x+x=1.25×1.0
解得x=0.25
所以转化率是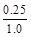 ×100%=25% ×100%=25%
碳是固体,所以增加碳的质量,平衡不移动,水蒸气的转化率不变。
(3)增加CO的浓度,平衡向正反应方向移动。因为反应是体积减小的、吸热的可逆反应,所以降低压强或降低温度平衡都向逆反应方向移动。
本题难度:一般
5、选择题 将1molSO2和1molO2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol。此时若移走0.5molO2和0.5molSO2,则反应达到新的平衡时,SO3的物质的量为 [???? ]
A.0.3 mol
B.0.15 mol
C.小0.15mol
D.大于0.15mol,小于0.3mol
参考答案:C
本题解析:
本题难度:一般
|