微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 不久前,科学家发现了一种新能源——“可燃冰”晶体.它的主要成分是甲烷与水分子(CH4·xH2O).据测定1 m3这种晶体可释放出140 m3甲烷气体(设气体体积已折算成标准状况,可燃冰的密度近似为1 g·cm-3).试推算该“可燃冰”中,CH4与H2O分子个数比为
A.1∶6
B.1∶7
C.1∶8
D.1∶9
参考答案:C
本题解析:根据甲烷的体积求其物质的量及甲烷的质量,进而求H2O的质量和物质的量.
本题难度:一般
2、填空题 一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 ???????????????。
(2)达到平衡后,保持容器容积不变,向体系中再加入一定质量的C,逆反应速率 ?????????(填“增大”、 “减小”或“不变”),化学平衡?????????(填“正移”、 “逆移”或“不变”);若保持温度不变,压缩容积,逆反应速率 ?????????,化学平衡?????????。
参考答案:(11分)
(1)15<Mr<18(3分)
(2
本题解析:
试题分析:
C(s)?? +??? H2O(g) ??? CO(g)?? +?? H2 (g)
??? CO(g)?? +?? H2 (g)
起始浓度??????? 2 mol?????? 2 mol
极限值之一是当反应物完全转化成生成物时,即体系中只有 CO(g) 和? H2 (g)
混合气体的平均相对分子质量为Mr=m气体总/n气体总 =(2×18+2×12)/4? =15
极限值之二是当反应物完全不转化成生成物时,即体系中只有C(s)和 H2O(g)
混合气体的平均相对分子质量为Mr=MH2O =18;则Mr的范围为15<Mr<18;
达到平衡后,保持容器容积不变,向体系中再加入一定质量的C,逆反应速率 不变,化学平衡不变;若保持温度不变,压缩容积,逆反应速率增大,化学平衡逆向移动
点评:此题要用到极限法求解。学生需要注意的是由于该反应是可逆反应,所以极限值达不到。
本题难度:一般
3、选择题 工业上可利用合成气(CO和H2的混合气体)生产甲醇。已知:
CO(g)+2H2(g) CH3OH(g) ΔH=—92.9kJ/mo1
CH3OH(g) ΔH=—92.9kJ/mo1
一定条件下,该反应在一体积固定的密闭容器中达到平衡。下列说法正确的是
A.该反应的△S<0
B.该反应在任何温度下均能自发进行
C.向容器中充入少量He,平衡向正反应方向移动
D.升高温度平衡向正反应方向移动
参考答案:A
本题解析:
试题分析:A、正反应是气体体积减小的方向,正确;B、该反应符合能量判据,违反熵判据,需要在一定条件下进行,错误;C、容积不变,增大压强,反应物和生成物浓度均不变,平衡不移动,错误;D、ΔH<0,升高温度平衡向逆反应方向移动,错误。
本题难度:一般
4、填空题 甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,CO与H2反应可制得甲醇:CO+2H2?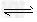 CH3OH 图1表示该反应进行过程中的能量变化;图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。??
CH3OH 图1表示该反应进行过程中的能量变化;图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。??
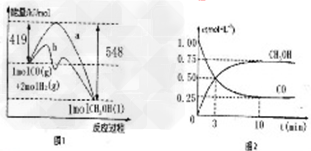
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,写出表示CH3OH燃烧热的热化学方程式_____________?。
(2)根据上图2计算:该温度下,反应CO(g)+2H2(g)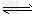 ?CH3OH(g)△H<0的平衡常数为___________;10min后,容器内的压强变为原来的____________倍;改变下列条件,能提高CO转化率的是____________?。
?CH3OH(g)△H<0的平衡常数为___________;10min后,容器内的压强变为原来的____________倍;改变下列条件,能提高CO转化率的是____________?。
A.降低温度 B.加催化剂 C.充入氩气,使体系压强增大
D.再充入1molCO和2molH2 E.恒温恒容改为恒温恒压
参考答案:(1)2CH3OH(l) + 3O2(g) =2CO2(g)
本题解析:
本题难度:一般
5、选择题 一定条件下,在体积不变的密闭容器中,能表示反应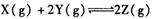 一定达到化学平衡状态的是
一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1:2:2?????②X的浓度不再变化
③容器中的压强不再变化?????????????????????④Z的物质的量不再变化
⑤气体的密度不再改变
A.①②③
B.②③④
C.②④⑤
D.①③⑤
参考答案:B
本题解析:略
本题难度:简单