微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)在试管里放入一小块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。若铜片还有剩余硫酸是否消耗完毕?
①结论及理由是:_________________________________________。
②向100毫升18 mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量?????????????
A.小于0·9 mol B.等于0·9 mol C.在0·9 mol与1.8 mol之间? D.大于1·8 mol
③50g的胆矾加热到100℃失去部分结晶水后,质量变为35.6g,则失去水后的硫酸铜晶体的化学式是??????????????
A.CuSO4·H2O B.CuSO4·2H2O? C.CuSO4·3H2O D.CuSO4
(2)足量的锌投入到一定量的浓硫酸中,充分反应后共收集到SO2和H222.4L(标准状况)。
①简述能产生H2的原因是____________????????????????????__________________
②上述变化中体现浓硫酸强氧化性的反应方程式是:???????????????????????????????
③反应共消耗金属锌的质量为_________g。
④以上数据能否计算出消耗的硫酸的物质的量? _??????????(填“能”或“不能”)
参考答案:(12分)(1)①否,随反应进行,硫酸浓度不断降低,稀硫酸与
本题解析:
试题分析:(1)①由于随反应进行,硫酸浓度不断降低,稀硫酸与铜不反应,所以硫酸会有剩余。
②浓硫酸的物质的量是1.8mol,所以根据反应式Cu+2H2SO4(浓)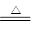 CuSO4+2H2O+SO2↑,并结合①可知,实际被还原硫酸的物质的量小于0.9mol,答案选A。
CuSO4+2H2O+SO2↑,并结合①可知,实际被还原硫酸的物质的量小于0.9mol,答案选A。
③50g的胆矾加热到100℃失
本题难度:一般
2、选择题 下列反应不属于四种基本反应类型,但属于氧化还原反应的是[???? ]
A. 2F2+2H2O=4HF+O2??????????
B. AgNO3+NaCl=AgCl↓ +NaNO3
C. 3CO+Fe2O3 2Fe+3CO2????
2Fe+3CO2????
D. MgCl2 Mg+Cl2 ↑
Mg+Cl2 ↑
参考答案:C
本题解析:
本题难度:简单
3、选择题 已知2.5克KClO3粉未和5.2克研细的碘在一定条件下按下式定量反应:
a KClO3 + bI2 + cHCl = eIClx + fKCl + gH2O,其中x的取值为
A.1
B.3
C.5
D.7
参考答案:B
本题解析:氯酸钾和碘单质的物质的量分别是0.02mol,则氯酸钾在反应中得到0.12mol,所以1mol单质碘即失去6mol电子,则碘在氧化产物中的价态是+3价,即x=3,答案选B。
本题难度:简单
4、选择题 下列反应属于氧化还原反应的是 [???? ]
A CaCO3+2HCl=CaCl2+CO2↑+H2O
B CaO+H2O=Ca(OH)2
C 2H2O2 2H2O+O2↑
2H2O+O2↑
D CaCO3 CaO+CO2↑
CaO+CO2↑
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列生产、生活中的实例不涉及氧化还原反应的是?(?????)??????????????????????????????????????????????
A.金属冶炼
B.点制豆腐
C.食物腐败
D.燃放鞭炮
参考答案:B
本题解析:
试题分析:金属冶炼是把金属从化合态变为游离态的过程;点制豆腐是胶体的聚沉反应,不是氧化还原反应;燃放鞭炮,因为有氧气参与反应,并生成化合态的氧,故一定设计氧化还原反应。
点评:氧化还原反应是高考的必考内容,考生应把握以下两点:一、判断一个反应是否属于氧化还原反应,以及氧化剂(产物)、还原剂(产物)分别是什么;二、利用得失电子配平所给化学反应,并能进行简单的有关于电子守恒的计算。
本题难度:简单