?
?
参考答案:(1)A?????(2)B ?①?? 2MnO4- + 5H
本题解析:
试题分析:(1)A.是复分解反应。不属于氧化还原反应,B、C、D都是氧化还原反应。选项为:A。(2)H2O2是常用的氧化剂。选项为:B。(3)①在反应中H2O2作还原剂变为O2和水;则氧化剂是MnO4-,反应后变为Mn2+。根据原子守恒和电子守恒可得到该反应的离子方程式是2MnO4- + 5H2O2 +6 H+ = 2Mn2++ 5O2↑ + 8H2O。②由上述离子方程式可知:每产生O2,转移电子2mol.。现在产生了标准状况2.24L氧气,即0.1mol,所以转移的电子的物质的量为0.2mol。
本题难度:困难
2、选择题 下列说法正确的是(??? )
①非金属只能作氧化剂②活泼的金属只能作还原剂
③金属阳离子都具有氧化性④金属阳离子只能作还原剂
A.①②
B.②③
C.③
D.④
参考答案:B
本题解析:本题考查对氧化还原反应概念的理解。
本题难度:简单
3、填空题 L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质,A、B分别代表两种含不同氯元素的物质(每种物质中,氮和氯元素的化合价只有一种);又知M中氮元素的化合价要比Q物质中氮元素的化合价低。在一定条件下,它们会发生如下的转化(未配平):
①P+A→Q+B?②L+O2→M+H2O?③L+M→R+H2O?④B+H2O→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是_______________________,理由是_____________________________________________________________________________。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途。据此推断在同温同压下,若物质R的密度比二氧化碳的密度小,则R的化学式为___________________________________________________________________。
(3)某学生写出下面三个含氮物质的相互转化的关系式:
(a)M+P→N2O3+H2O? (b)N2O4+H2O→P+Q? (c)M+L→Q+H2O
其中一定不可能实现的是____________,理由是____________________________________
______________________________________________________________________________。
参考答案:(1)P? P在五种含氮化合物中化合价最高
(2)N2
本题解析:由反应④可知化合价B>A(因氧元素化合价升高,则Cl元素化合价降低), 再由反应①知化合价P>Q,由②知化合价M>L,由③知化合价M>R>L,故P中N元素化合价最高。由②知L为NH3,M为NO,由③知R可能为N2和N2O,又因为R的密度比CO2小,故R为N2。
本题难度:简单
4、填空题 美国科学家理查德·海克和日本科学家根岸英一、伶木彰因在研发“有机合成中的钯催化的交叉偶联”而获得诺贝尔化学奖。有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收,一种由废催化剂制取氯化钯的工艺流程如下:

(1)甲酸还原氧化钯的化学方程式为????????。
(2)钯在王水(浓硝酸与浓盐酸按体积比1:3)中转化为H2PdC14,硝酸被还原为NO,该反应的化学方程式为:????????????。
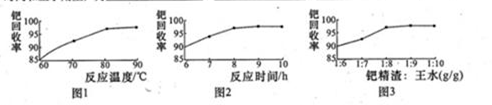
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如下图1—图3所示,则王水溶液钯精渣的适宜条件(温度、时间和王水用量)为????????、????????、????????。
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2—。此时铁的存在形式是????????(写化学式)
(5)700℃焙烧1的目的是:????????;550℃焙烧2的目的是:????????。
参考答案:(15分)(1)PdO+HCOOH 本题解析: 本题解析:
试题分析:(1)氧化钯的还原产物是Pd,而甲酸的氧化产物是CO2,所以甲酸还原氧化钯的化学方程式为)PdO+HCOOH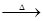 ?Pd+CO2↑+H2O。 ?Pd+CO2↑+H2O。
(2)根据原子守恒可知,反应中还有水生成,因此反应的化学方程式是3Pd+12HCl+2HNO3=3H2PdCl4+2NO↑+4H2O。
(3)根据
本题难度:一般
5、选择题 下列物质中,既有氧化性,又有还原性的是(??? )
A.Cl2SO2
B.NaMg
C.H2SO4HNO3
D.Cl2H2SO4
参考答案:A
本题解析:物质中的元素介于中间价态时既有氧化性,又有还原性。
本题难度:简单
|