微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铁盐、亚铁盐是实验室常用的药品。根据题意完成下列填空:
(1)若向硫酸亚铁溶液中滴加稀硝酸,可以看到溶液逐渐变黄。为检验最后溶液中是否还有亚铁离子剩余,可以_____________________________________________;向已酸化的FeCl3溶液中逐滴加入Na2S溶液,有浅黄色沉淀生成,溶液逐渐变为浅绿色。写出该反应的离子方程式??????????????????????。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生。呈红色的物质是????????????(写化学式)。
已知:11H2O2+2SCN—→2SO42—+2CO2↑+ N2↑+10H2O +2H+若生成1mol N2,H2O2和SCN—的反应中转移电子物质的量是???????mol。
(3)由以上实验,推断Fe2+、S2—和SCN—的还原性强弱??????(按从强到弱顺序排列)。
(4)向FeCl3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4)。写出此过程的离子方程式、配平并标出电子转移的数目和方向?????????????????????????????????????。
2、选择题 水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:
3Fe2+ + 2S2O32- + O2 + aOH-="=" Y+ S4O62- + 2H2O,下列说法中不正确的是???
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol
D.S2O32-是还原剂
3、填空题 (1)已知2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是???????,氧化产物是?????。若生成氯气11.2L(标准状况),则转移电子的物质的量为?????mol。
(2)配置0.2mol/L的NaCl溶液450mL, 需要用到的仪器有托盘天平(含砝码)、药匙、烧杯、玻璃棒、_____________和______,需要用托盘天平称取NaCl__________g。
(3)漂白粉的有效成分是_______________
(4)已知每1 克氢气完全燃烧生成水蒸气时将放出121kJ热量,写出该反应的热化学方程式___________________________________________
4、选择题 检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2=I2+2H2O,下列对该反应的叙述中不正确的是( )。
A.I2为氧化产物
B.H2O2既作氧化剂又作还原剂
C.氧化性强弱顺序为H2O2>I2
D.生成1 mol I2时转移2 mol电子
5、选择题 已知反应3Cl2+6NaOH(浓)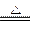 5NaCl+NaClO3+3H2O,下列有关说法正确的是 (???)
5NaCl+NaClO3+3H2O,下列有关说法正确的是 (???)
A.得电子的氯原子数是失电子氯原子数目的6倍
B.被氧化的氯原子数是被还原的氯原子数目的5倍
C.Cl2既是氧化剂,又是还原剂
D.反应中电子转移数为6 mol