微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 FeCl3、CuCl2混溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是(???)
A.加入KSCN的溶液一定不变红色
B.溶液中一定含Cu2+
C.溶液中一定含有Fe2+
D.剩余固体中一定有铜
参考答案:B
本题解析:
答案:B
B、不正确,氧化性:Fe3+>Cu2+ 先发生 Fe+2Fe3+=3Fe2+ 再发生? Fe+Cu2+=Fe2++Cu,溶液中可能含有Cu2+ 。A溶液中肯定无Fe3+ ,否则要与Cu2+ 发生反应,C正确,溶液中一定含有Fe2+;D.正确,剩余固体中一定有铜。
本题难度:一般
2、简答题 生活中常使用的铝合金中的铝来自于电解熔融氧化铝.用于工业电解的氧化铝要求其纯度不得低于98.2%,而天然铝土矿中的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下所示:
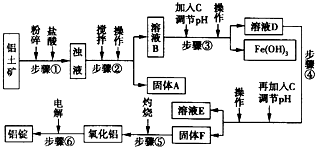
一些难溶物开始沉淀和完全沉淀的pH如表所示:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2
开始沉淀pH(离子初始浓度为0.01mol、L)
4
2.3
10.4
完全沉淀pH(离子浓度<10-5mol/L)
5.2
4.1
12.4
请回答下列问题:
(1)加入盐酸时,氧化铝与盐酸发生反应的离子方程式为______.
(2)步骤②③④中操作的名称为______.
(3)固体A的化学式为______;物质C的化学式为______:溶液中的Na+、Ca2+、Mg2+是在步骤______中除去的.
(4)步骤③中调节溶液pH的数值范围为______,步骤④中调节溶液pH的数值范围为______.
(5)步骤⑥中发生反应的化学方程式为______.
参考答案:(1)氧化铝和盐酸反应生成氯化铝和水,离子反应方程式为:Al
本题解析:
本题难度:一般
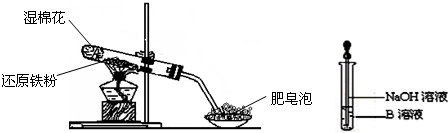
3、简答题 某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______.
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是______,若溶液未变红色则说明硬质试管中固体物质的成分是______.
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:______(用离子方程式表示).
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式:______.
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有______性.由此可知,实验室中FeSO4溶液要临时配制并加少量铁粉的原因是______.
参考答案:(1)铁与水蒸气反应会生成四氧化三铁和氢气,反应的化学方程式
本题解析:
本题难度:一般
4、选择题 某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42- 的物质的量浓度为6 mol·L-1,则此溶液最多溶解铁粉的质量为(??)
A.5.6 g
B.11.2 g
C.22.4 g
D.33.6 g
参考答案:C
本题解析:
试题分析:n(SO42-)=0.1L×6mol?L-1=0.6mol,CuSO4、Fe2(SO4)3、H2SO4的溶液中阳离子的浓度相同,则有n(Cu2+)=n(H+)=n(Fe3+),由于溶液中阳离子的浓度相同,所以阳离子物质的量也相同,设Cu2+、Fe3+、H+三种离子物质的量均为n,根据电荷守恒知道:2n+3n+n=0.6mol×2,由此解得n=0.2mol,
Cu2+、H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.6mol,根据Fe的守
本题难度:一般
5、选择题 有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A.0.5 mol/L
B.3.0 mol/L
C.2.0 mol/L
D.1.0 mol/L
参考答案:D
本题解析:本题涉及的反应较多,若按各步反应进行计算则无从下手,可采用守恒法,由于得到沉淀最多时,溶液中的溶质只有NaCI,则n(HCI)=n(NaOH)=0.250×2.0=0.50moL,C(HCI)=1.0moL/L,D正确。
本题难度:一般
|