??????????????????????
?
限选试剂:稀盐酸、新制的氯水、0.1mol.L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ.兴趣小组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:_______________
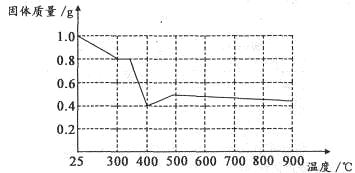
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设二不成立。你是否同意该同学的结论,并简述理由:______________________。????????????
参考答案:Ⅰ:(1)全部是Fe
(2)
实验步骤
本题解析:
试题分析:
Ⅰ(1)根据物质的组成及后面的假设情况可以推知假设一为固体全部是Fe。(2)步骤一:若固体中含有FeO、Fe.则由于金属Fe是比较活泼的金属,能把活动性比它若的金属置换出来。所以可以向固体混合物中加入硫酸铜溶液,充分振荡后静置,若看到溶液的颜色变浅,同时产生暗红色的固体。就证明含有Fe单质。步骤三:将步骤而所得的的固体加入到足量的稀HCl中,发生反应:FeO+2HCl=FeCl2+H2O.充分振荡后静置,取上层清液,滴加几滴KSCN溶液,无现象,再滴加几滴新制的氯水 ,充分振荡,
本题难度:一般
2、选择题
A.9.6 g
B.6.4 g
C.3.2 g
D.1.6 g
参考答案:C
本题解析:由题意知,Cu、Ag与HNO3反应所得还原产物与O2作用溶于水后又变为HNO3,因此可以认为Cu、Ag所失电子最终被O2而非HNO3所得。
设Cu、Ag物质的量分别为x、y,则:

解得:x="0.050" mol,m(Cu)="64"
本题难度:一般
3、选择题 m g FeO、Fe2O3、CuO的混合物,加入120mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液40mL;将m g的混合物用CO气体加热还原,实验过程中耗去标准状况下的CO3.36升,得固体w g。则w的值为
A.m-0.96
B.m-1.44
C.m-1.6
D.m-2.4
参考答案:B
本题解析:向所得溶液中加入NaOH溶液,是为了中和体系中的硫酸,故体系中硫酸为0.03mol。所以生成金属硫酸盐的硫酸根离子为0.12-0.03=0.09mol。因原氧化物中氧原子数目与金属硫酸盐中硫酸根离子数目相等,故混合物中的氧原子也为0.09mol,质量为0.09*16=1.44克,所以混合物中金属的质量w=m-1.44。
故选B
本题难度:简单
4、填空题 判断存放的FeCl2溶液是否变质。从现象观察看????????????????????????????;鉴定的方法为加入?????????试剂,若溶液出现 ???????????????????????????????;则证明有????????????存在。实验室为了防止FeCl2溶液变质,在配制时常加入 ???? ??? 和 ????? 。向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象????????????????????????????????????????。 ???????????????????????????????;则证明有????????????存在。实验室为了防止FeCl2溶液变质,在配制时常加入 ???? ??? 和 ????? 。向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象????????????????????????????????????????。
参考答案:溶液是否变为黄色;KSCN;血红色; Fe3+; 铁粉.盐酸
本题解析:略
本题难度:一般
5、选择题 当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的有????????????????????????????????????(???)

A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子

B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应

C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,只发生了氧化反应

D.反应过程中消耗的SO2与生成的SO2的物质的量相等
参考答案:A
本题解析: 蓝色沉淀溶于氨水生成深蓝色的溶液,为Cu(NH3)42+;白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,故发生了氧化还原反应;SO2还要中和过量的氨水,故消耗的SO2与生成的SO2的物质的量不可能相等。 蓝色沉淀溶于氨水生成深蓝色的溶液,为Cu(NH3)42+;白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,故发生了氧化还原反应;SO2还要中和过量的氨水,故消耗的SO2与生成的SO2的物质的量不可能相等。
本题难度:一般
|