微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知25 。C时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为 1.25×10-5 mol/L。若在5 mL含有KCl和KI各为0.01 mol/L的溶液中,加入8 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是[???? ]
A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-)
参考答案:A
本题解析:
本题难度:一般
2、计算题 铜及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS)。写出CuSO4转变为铜蓝的离子方程式_______________________________。
(2)工业上以黄铜矿CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
(3)图I是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图II是粗铜精炼的装置图,假若用燃料电池为电源进行粗铜的精炼实验。
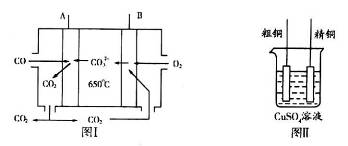
①写出A极的电极反应式__________________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,粗铜板应与__________极(填“A”或“B”)相连;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为___________。
③当消耗标准状况下1.12LCO时,精铜电极的质量变化情况为_________。
(4)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是________(填序号)
A.Ksp(CuCO3)<Ksp(CaCO3)
B.c(Cu2+)<c(Ca2+)
C.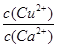 >
>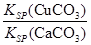
D.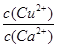 <
<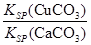
参考答案:(14分)(1)Cu2+(aq)+ZnS(s)=Zn2+(a
本题解析:
试题分析:(1)硫化铜的溶解度小于氯化锌的,所以根据沉淀容易向更难溶的方向转化可知,该反应的离子方程式是Cu2+(aq)+ZnS(s)=Zn2+(aq)+CuS(s)。
(2)根据反应的方程式可知,铜元素的化合价从+1价降低到0价,得到1个电子,S元素的化合价从-2价升高到+4价,失去6个电子,所以Cu2S是还原剂,Cu2O和Cu2S是氧化剂。SO2具有漂白性,能使品红溶液褪色,据此可以鉴别SO2,所以正确的操作是将气体通入品红溶液,溶液褪色,加热恢复原色。
(3)①原电池中较活泼的金
本题难度:困难
3、填空题 在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____________沉淀(填化学式),生成该沉淀的离子方程式为________________。已知25 ℃时Ksp[Mg(OH)2] = 1.8×10-11,Ksp[Cu(OH)2] = 2.2×10-20。
参考答案:.(1)Cu(OH)2,??? (2)Cu2+ + 2NH3
本题解析:
试题分析:氢氧化铜的溶度积常数小于氢氧化镁的溶度积常数,所以在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成氢氧化铜沉淀,反应的离子方程式是Cu2+ + 2NH3·H2O = Cu(OH)2↓+ 2NH4+。
点评:该题是基础性试题的考查,主要是考查学生灵活运用溶度积常数解决实际问题的能力,有利于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。该题的关键是明确溶度积常数的含义以及表达式,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 下列说法正确的是[???? ]
A、制备硫酸亚铁铵的实验中最后制得的晶体过滤后用蒸馏水洗涤
B、AgI?沉淀中滴入稀KCl溶液,有白色沉淀出现,说明AgCl比AgI更难溶
C、倾析法是将不溶物充分沉淀后,先转移沉淀后转移液体
D、配制好的氢氧化钠溶液用邻苯二甲酸氢钾滴定浓度时,采用酚酞为指示剂
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列有关沉淀溶解平衡的说法正确的是( )
A.KSP(AB2)小于KSP(CD),则物质AB2的溶解度一定小于物质CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的KSP增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
参考答案:A、因比较不同类型的难溶物的溶解度大小,必须通过计算溶解度比
本题解析:
本题难度:简单