微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后
A.溶液的pH变大
B.c(Na+)与c (CO32-)的比值变大
C.溶液浓度变大,有晶体析出
D.溶液浓度不变,有晶体析出
参考答案:D
本题解析:试题分析:电解饱和Na2CO3溶液,实际是电解水。一段时间后,随着水的减少,饱和溶液中会有晶体析出。根据公式: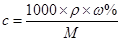 ,因为电解前后,此溶液均为饱和溶液,故其浓度保持不变,因此答案选D。
,因为电解前后,此溶液均为饱和溶液,故其浓度保持不变,因此答案选D。
考点:电解质溶液;水解;溶液浓度
点评:本题是对电解质溶液的综合考查。对于溶液的浓度,应牢记此公式: 。同时,对于饱和溶液,由于水的减少,会导致晶体的析出。
。同时,对于饱和溶液,由于水的减少,会导致晶体的析出。
本题难度:困难
2、选择题 室温下,在pH=12的某溶液中,有甲、乙、丙、丁四位同学计算出由水电离出的c(OH-)的数据分别为甲:1.0×10-7mol·L-1;乙:1.0×10-6mol·L-1;丙:1.0×10-2mol·L-1;丁:1.0×10-12 mol·L-1。其中你认为正确的数据是 [???? ]
A.甲
B.乙
C.丙
D.丁
参考答案:CD
本题解析:
本题难度:一般
3、选择题 在KHSO4的水溶液及熔化两种状态下都能存在的离子是
A.K+
B.H+
C.HSO4-
D.SO42-
参考答案:A
本题解析:物质熔化可破坏离子键,但不能破坏共价键,在水溶液中,可破坏离子键也可破坏强极性共价键。KHSO4熔化电离:KHSO4 K++ HSO4-?,水溶液电离:KHSO4
K++ HSO4-?,水溶液电离:KHSO4![]() K++H++ SO42-。
K++H++ SO42-。
本题难度:困难
4、选择题 下列叙述正确的是
A.0.1mol·L-1氨水中,c (OH-)= c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)= c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,
c(Na+)= 2c(A2-)+c(HA-)+c(H2A)
参考答案:C
本题解析:A.0.1mol·L-1氨水中,溶液显碱性,c (OH-)>c(H+),根据电荷守恒:c (OH-)= c(NH4+)+c(H+),c (OH-)>c(NH4+)。
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,很多同学错认为溶液的c (OH-)=  =0.01mol/L,pH=10,但忽略题目未涉及到温度,如果是非“常温下”,则计算是错误的;
=0.01mol/L,pH=10,但忽略题目未涉及到温度,如果是非“常温下”,则计算是错误的;
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,电荷守恒:c(Na+)= 2c(A2-)+c(HA-)+c(OH-)。
点评:考查电解质溶液中守恒问题,离子浓度大小比较。
本题难度:简单
5、选择题 常温下某溶液中由水电离的c(H+)=1×10-10 mol/L,该溶液中溶质不可能是
A.NaHSO4
B.Al2(SO4)3
C.NaOH
D.HCl
参考答案:B
本题解析:
本题难度:一般
[-pag e-]
1、选择题 已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO42-某温度下,向pH=6的蒸馏水中加入
NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列叙述中,不正确的是 [???? ]
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-12mol·L-1
C.加入NaHSO4晶体抑制了水的电离
D.该温度下加入等体积pH为10的NaOH溶液可使该溶液恰好呈中性
2、选择题 常温下,某溶液的pH=5,则由水电离出的c(H+)可能是
A.1×10—6 mol/L
B.1×10—7 mol/L
C.1×10—8 mol/L
D.1×10—9 mol/L
3、选择题 25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba(OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是 [???? ]
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
4、选择题 当用标准盐酸溶液滴定待测氢氧化钠溶液时,下列操作中会使测定结果偏低的是( )
A.用酸式滴定管滴至终点时,俯视滴定管读数
B.将碱液移入锥形瓶后,加了10 ml蒸馏水再滴定
C.酸式滴定管用蒸馏水润洗后,未用标准盐酸溶液润洗
D.酸式滴定管注入酸液时,尖嘴处留有气泡,达滴定终点时气泡消失
5、选择题 常温下,下列对有关溶液的判断不正确的是( )
A.Na2CO3溶液中,c(OH-) = c(H+)+c(HCO3